Miofilamente Vrste, struktura in organizacija
- 3688
- 598
- Roman Schamberger
The Miofilamente So kontraktilni proteini miofibrilov, ki so strukturne enote mišičnih celic, podolgovate celice, ki jih imenujemo mišična vlakna.
Mišična vlakna in njihove sestavne dele imajo posebna imena. Na primer, membrana, citoplazma, mitohondrije in endoplazemski retikulum so znani kot sarkolema, sarkoplazma, sarkosomi in sarkoplazemski retikulum,.
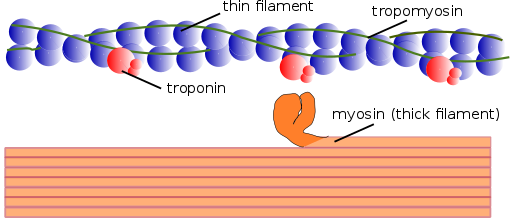
 Struktura miofilamentov (vir: Mikael Häggström, ki se uporablja s prepustnostjo. [Javna domena] prek Wikimedia Commons)
Struktura miofilamentov (vir: Mikael Häggström, ki se uporablja s prepustnostjo. [Javna domena] prek Wikimedia Commons) Na enak način se kontraktilne elemente v notranjosti imenujejo miofibrili skupaj; in kontraktilne beljakovine, ki sestavljajo miofibrile, se imenujejo miofilamente.
Obstajata dve vrsti miofilamentov: tanke in debeline. Tanke nitke so sestavljene predvsem iz treh beljakovin: aktin F, tropomiozin in troponin. Debele nitke so medtem sestavljene le iz drugega beljakovin, znanega kot Myosina II.
Poleg teh obstajajo tudi drugi beljakovine, povezane z debelimi in tankimi filamenti, vendar nimajo kontraktilnih funkcij, če ne raje strukturne, med katerimi so našteti le nekaj, titine in nebulina.
[TOC]
Vrste mišičnih vlaken
Posebna razporeditev miofilamentov, ki predstavljajo miofibrile, povzroča dve vrsti mišičnih vlaken: progata mišična vlakna in gladka mišična vlakna.
Stražena mišična vlakna pri pregledu optičnega mikroskopa prikazujejo vzorec striroznih ali prečnih pasov, ki se ponavljajo po celotni površini in ki podeljujejo ime mišice, ki jih vsebuje, iz stroge mišic. Obstajata dve vrsti proganih mišičnih vlaken, skeletnih in srčnih.
Mišična vlakna, ki ne kažejo, da se vzorec navzkrižnih pasov imenuje gladka vlakna. Oni so tisti, ki sestavljajo muskulaturo žilnih sten in viscere.
Struktura
Tanki miofilamenti
Ti miofilamenti so sestavljeni iz aktina F in dveh povezanih beljakovin: tropomiozin in troponina, ki imata regulativne funkcije.
Actin F ali filamentni aktin je polimer iz drugega manjšega globularnega proteina, imenovanega aktin g ali kroglični aktin, približno 42 kDa molekulske mase. Ima sindikalno mesto za miozin in je naročeno, da tvorita dve verigi, razporejeni kot dvojni propeler, sestavljen približno 13 monomera na korak.
Lahko vam služi: proteoliza: vrste in funkcijeZa aktinske filamente je značilno, da imata dva pola: en pozitiven, usmerjen proti Discu Z, in še en negativni, razporejeni proti središču Sarcomero.
Tropomiozin je sestavljen tudi iz polipeptidne verige z dvojnim dvojnim propelerjem. To je 64 kDa protein, ki tvori nitke, ki se nahajajo v brazdah, ki jih pustijo dvojne propelerske verige tankih filamentov aktina F, na primer "polnjenje" praznih presledkov v propelerju.
V mirovanju tropomiozin pokriva ali "pokrovi" sindikalnih mest za miozin, kar preprečuje interakcijo obeh beljakovin, kar povzroča krčenje mišic. Okoli vsake tanke filamente in približno 25 ali 30ηm od začetka vsakega tropomiozina je še en protein, imenovan troponin.
Troponin (TN) je beljakovinski kompleks, sestavljen iz treh podenot krogličnih polipeptidov, imenovanih troponin T, C in I. Vsaka molekula tropomiozin ima povezan kompleks troponina, ki ga uravnava, in skupaj sta odgovorna za regulacijo začetka in dokončanje krčenja mišic.
Debela miofilamente
Debele filamente so polimeri miozina II, ki tehta 510 kDa in jih tvorita dve težki verigi 222 kDa in štiri svetlobne verige. Lahke verige so dveh vrst: bistvene svetlobne verige, 18 kDa in regulativne svetlobne verige 22 kDa.
Vsaka težka veriga Myosina II ima obliko trsa z majhno kroglasto glavo na koncu, ki je projicirana skoraj 90⁰ in ima dve pritrdilni mesti, eno za aktin in eno za ATP. Zato ti proteini pripadajo družini Atasas.
Debela filament je sestavljena iz več kot 200 molekul miozina II. Globolarna glava vsake od teh molekul deluje kot "veslanje" med kontrakcijo in potisne aktin, na katerega je povezan, tako da zdrsne proti središču Sarcomero.
Organizacija
V skeletnih mišičnih vlaken miofibrili zasedajo večino sarkoplazme in so razporejeni v vzdolžnih in urejenih sklopih po celotni celici.
Vam lahko služi: mitohondrijeV vzdolžnem rezu, ki ga vidimo z optičnim mikroskopom, lahkimi pasovi, imenovanimi pasovi I, in temnimi pasovi, imenovani pasovi a pasovi. Ti pasovi ustrezajo urejenosti miofibrilov in s tem miofilamentov, ki jih sestavljajo.
V središču pasu I je temna in tanka črta, imenovana Line ali Disc Z. Središče vsakega pasu A predstavlja jasnejše območje, znano kot pas H, ki je v središču razdeljena s temnejšo črto, imenovano M Line.
Opisana je med dvema z linijama, opisana je struktura, imenovana Sarcomer, ki je funkcionalna enota skeletnih mišic. Sarcomer je sestavljen iz kontraktilnih miofilamentov, razporejenih v pasovih A, H in hemi-pasu na vsakem koncu.
Pasovi I vsebujejo samo tanke filamente, pas vsebuje debele filamente, prepletene na njihovih dveh koncih s finimi nitkami in pas H vsebuje samo debele nitke.
Kako so miofilamenti organizirani znotraj sarcomerov?
Pri pregledu vzorca skeletnih mišic pri elektronskem mikroskopu lahko opazimo tako debele miofilamente kot tanke miofilamente. Govori se, da so ti, ki so "prepleteni" ali "prepleteni" med seboj v zaporednem, urejenem in vzporednem dispoziciji.
Tanke filamente izvirajo iz z diskih z in segajo na vsako stran v nasprotni smeri in proti sredini vsakega sosednjega sarcomera. Iz z diskov na vsakem koncu sarcomera, v sproščeni mišici, aktin doseže začetek pasu H na vsaki strani.
Tako v mišičnih vlaknih skeletnih mišic sprostijo debele miofilamente zavzemajo osrednje območje, ki tvori temne pasove ali pasove A; In tanke filamente segajo na obeh straneh sarcomerja, ne da bi prišli.
V prerezu v regiji, kjer se prekrivajo debele in tanke nitke, lahko opazimo šesterokotni vzorec, ki vključuje debele filamente v sredini in šest tankih nitk, ki ga obdaja Šesterokotnik.
Vam lahko služi: Simplasto: deli in značilnostiTo organizacijo miofilamentov v sarcomeru ohranja funkcijo niza beljakovin, povezanih z miofilamenti, in ki imajo strukturne funkcije, med katerimi je mogoče poudariti titin, alfa aktin, nebulin, miomesin in protein C.
Mehanizem krčenja
Ko se v nevromuskularni plošči zaradi stimulacije motoričnega nevrona sprosti acetil holin (nevrotransmiter), se mišična vlakna vzbudi in odprejo kalcijeve kanale, ki so odvisni od napetosti.
Kalcij se veže na troponin C in to ustvari konformacijsko spremembo tropomiozina, ki izpostavlja aktivna mesta in tako sproži krčenje. Ko raven kalcija pade, se tropomiozin vrne v svoj začetni položaj in krčenje preneha.
Izpostavljenost sindikalnih mest aktina z miozinom omogoča, da se obe beljakovini pridružijo in da miozin potisne aktin proti središču sarcomera in drsi nad miozinom.
Med krčenjem mišic se z črte z vsakega sarcomerja približajo sredini in se približujejo črti M, povečajo interdigitacijo med aktinom in miozinom ter zmanjšajo velikost pasov I in H. Stopnja skrajšanja bo odvisna od vsote skrajšanja vsakega od sarcomerjev krmljene mišice.
Reference
- Berne, r., & Levy, m. (1990). Fiziologija. Mosby; Mednarodna izdaja.
- Lisica, s. Yo. (2006). Človeška fiziologija (9. izd.). New York, ZDA: McGraw-Hill Press.
- Gartner, l., & Hiatt, J. (2002). Besedilo histologije atlasa (2. izd.). Mehika d.F.: McGraw-Hill Meraameriški uredniki.
- Murray, r., Bender, d., Botham, k., Kennelly, str., Rodwell, v., & Weil, P. (2009). Harperjeva ilustrirana biokemija (28. izd.). McGraw-Hill Medical.
- Rawn, j. D. (1998). Biokemija. Burlington, Massachusetts: Založniki Neil Patterson.
- Ross, m., & Pawlina, w. (2006). Histologija. Besedilo in atlas s korelirano celično in molekularno biologijo (5. izd.). Lippinott Williams & Wilkins.
- Zahod, J. (1998). Fiziološka osnova medicinske prakse (12ava ed.). Mehika d.F.: PAN -american Medical Uredništvo.

