Metilna ali metilna skupina

- 4992
- 467
- Dexter Koch
On Metilna ali metilna skupina Gre3. Je najpreprostejši od vseh gaziranih substituentov v organski kemiji, ima en sam ogljik in tri vodike; izhaja iz plina metana. Ker je lahko povezan le z drugim ogljikom, njegov položaj označuje konec verige, njegovo odpoved.
Na spodnji sliki imate eno od številnih predstav za to skupino. Sinuje na vaši desni kažejo, da za povezavo H3C- Lahko obstaja kateri koli atom ali substituent; alkil, R, aromatični ali arilo, AR ali heteroátomo ali funkcionalna skupina, kot sta OH ali CL.
 Metilna skupina je najpreprostejša gazirana substituenta v organski kemiji. Vir: su-no-g [javna domena]
Metilna skupina je najpreprostejša gazirana substituenta v organski kemiji. Vir: su-no-g [javna domena] Ko je funkcionalna skupina, povezana z metilom, OH, imamo metanol alkohol, CHO3Oh; In če je to CL, bomo imeli metil klorid, Cho3Cl. V organski nomenklaturi se omenja preprosto kot "metil", pred katerim je število njegovega položaja v najdaljši ogljikovi verigi.
Metilo ch skupina3 Preprosto ga je prepoznati med razjasnitvami organskih struktur, zlasti zaradi ogljikove jedrske magnetne resonančne spektroskopije 13 (RMN C (RMN C13). Iz nje po močnih oksidacijah dobimo skupine COOH kisline, ki je sintetična pot za sintezo karboksilnih kislin.
[TOC]
Reprezentacije
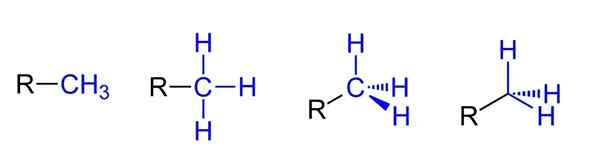 Možne reprezentacije za metilno skupino. Vir: Jü prek Wikipedije.
Možne reprezentacije za metilno skupino. Vir: Jü prek Wikipedije. Zgoraj imate štiri možne predstavitve, ob predpostavki, da je CHO3 Povezan je z RICO substituent r. Vsi so enakovredni, a čeprav prostorski vidiki molekule gredo od leve proti desni.
Na primer r-ch3 daje vtis, da je ravno in linearno. Naslednja predstavitev prikazuje tri C-H kovalentne vezi, ki omogočajo prepoznavanje metila v kateri koli strukturi Lewisa in dajejo lažni vtis, da je križ.
Vam lahko služi: kaj je erristeneo?Nato po desni (predzadnji) opazimo hibridizacijo SP3 V avtomobilu Caron3 Zaradi tetraedrske geometrije. V zadnji predstavitvi kemični simbol ogljika sploh ni napisan, vendar se tetraeder vzdržuje, da označuje, kateri atomi H so spredaj ali za ravnino.
Čeprav ni na sliki, je v času zastopanja Cho še en zelo ponavljajoč se3 Sestavljen je iz preprosto postavitve skripta (-) "golega". To je zelo koristno, ko se narišejo veliki ogljikovi okostji.
Struktura
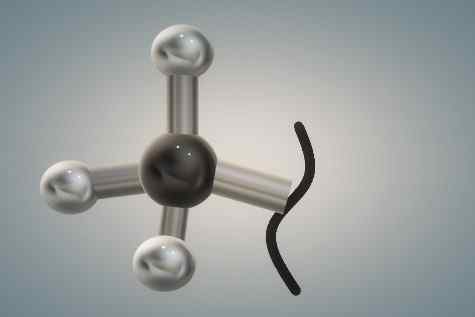 Struktura metilnih skupin, ki jo predstavlja model kroglic in palic. Vir: Gabriel Bolívar.
Struktura metilnih skupin, ki jo predstavlja model kroglic in palic. Vir: Gabriel Bolívar. Zgornja slika je tridimenzionalna predstavitev prvega. Črna in bujna krogla ustreza ogljikovi atomu, beli pa vodikovi atomi.
Ponovno ima Carbon produkt tetraedrskega okolja hibridizacije SP3, In kot tak je relativno obsežna skupina, z vrtenjem njegove sterično preprečene povezave C-R; To pomeni, da se ne more vrteti, ker bi bele sfere motile elektronske oblake sosednjih atomov in bi začutile njihovo odbojnost.
Vendar lahko povezave C-H vibrirajo, tako kot povezava C-R. Zato Cho3 Gre za skupino tetraedrske geometrije, ki jo je mogoče razjasniti (določiti, ugotoviti) z infrardečo sevalno spektroskopijo (IR), kot vse funkcionalne skupine in ogljikove vezi s heteroátomos.
Najpomembnejše pa je njegovo razjasnitev z NMR13. Zahvaljujoč tej tehniki je določena relativna količina metilnih skupin, kar omogoča sestavljanje molekulske strukture.
Vam lahko služi: cenjene rešitveNa splošno je več skupin CHA3 Naj bodo molekula, bolj "nerodna" ali neučinkovita, njene medmolekularne interakcije; to pomeni, da bodo mladoletniki njene točke taljenja in vrelišča. Skupine pogl3, Zaradi svojih vodikov se med seboj "zdrsnejo", ko se približajo ali dotikajo.
Lastnosti
Za metilno skupino je značilno, da je hidrofobna in apolarna.
To je zato, ker njihove C-H vezi niso zelo polarne zaradi nizke razlike med ogljikovo in vodikovo elektronegativnosti; In poleg tega njegova tetraedrska in simetrična geometrija svoje elektronske gostote razdeli skoraj homogeno, kar prispeva k zaničevalnemu dipolnemu trenutku.
V odsotnosti polarnosti Cho3 "Voda" vode, ki se obnaša kot hidrofobna. Če jo vidimo v molekuli, bo znano, da ta metilni konec ne bo učinkovito vplival na vodo ali drugim polarnim topilom.
Še ena značilnost ch3 To je vaša relativna stabilnost. Razen če atom, ki je povezan z njega odtegnitve elektronske gostote, ostane praktično inerten pred zelo močnimi kislimi sredstvi. Vendar bo razvidno, da lahko sodeluje v kemičnih reakcijah, predvsem na njegovo oksidacijo ali migracijo (metilacija) v drugo molekulo.
Reaktivnost
Oksidacije
Pogl3 ni izvzet za oksidacijo. To pomeni, da je dovzetno za oblikovanje povezav s kisikom, C-O, če reagira z močnimi oksidacijskimi sredstvi. Ko oksidira, postane različne funkcionalne skupine.
Na primer, njegova prva oksidacija povzroči skupino Metiol (ali hidroksimetil), CHO2Oh, alkohol. Drugi, izhaja v skupini Formil, CHO (HC = O), aldehida. In tretji finale.
Vam lahko služi: ionizacijska konstantaTa serija oksidacij se uporablja za sintezo benzojske kisline (Hooc-C6H5) Iz toluena (h3DC6H5).
Ioni
Pogl3 Med mehanizmom nekaterih reakcij lahko osvojite trenutne električne obremenitve. Na primer, ko se metanol segreva v zelo močnem kislinskem mediju, v teoretični odsotnosti nukleofilov (iskalniki pozitivne obremenitve) se oblikuje metilični kation3+, Ker je povezava CHO pokvarjena3-Oh in oh, pridete s parom obveznic elektroni.
Vrsta pog3+ Tako je reaktiven, da ga je bilo mogoče določiti le v plinski fazi, saj reagira ali izgine na najmanjšo prisotnost nukleofila.
Po drugi strani pa Cho3 Prav tako lahko dobite anion: metanuro, ch3-, Najpreprostejši karbanion vseh. Vendar, kot Cho3+, Njegova prisotnost je nenormalna in poteka le v ekstremnih pogojih.
Reakcija metilacije
V reakciji metilacije se prenese ch3 do molekule brez električnih nabojev (CHO3+ niti pogl3-) v postopku. Na primer metil jodid, cho3I, je dobro metintovo sredstvo in lahko nadomestim O-H povezavo več molekul z enim O-CH3.
Pri organski sintezi to ne pomeni nobene tragedije; Ko pa je tisto, kar je pretirano metil, dušikove baze DNK.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Rahul Gladwin. (23. november 2018). Metilacija. Encyclopædia Britannica. Okrevano od: Britannica.com
- Danielle Reid. (2019). Metilna skupina: struktura in formula. Študij. Okrevano od: študij.com
- Wikipedija. (2019). Metilna skupina. Pridobljeno iz: v.Wikipedija.org
- « Enegonske lastnosti, kako narediti enegon, primeri
- Molarni koncept in formula, izračun in primeri »

