Alkalineterne kovine
- 5066
- 55
- Ms. Pablo Lebsack
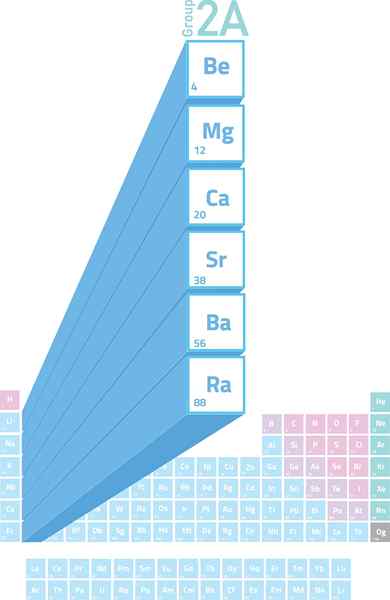
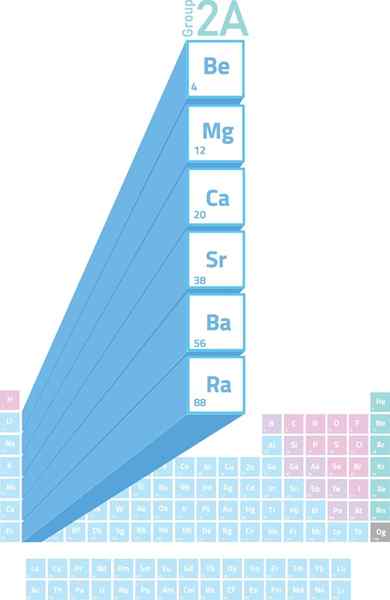 Lokacija alkalinoternih kovin v periodični tabeli
Lokacija alkalinoternih kovin v periodični tabeli Kaj so alkalne kovine?
The Alkalineterne kovine So elementi skupine 2 (prej imenovane skupine 2A) periodične tabele. To pomeni, da jih tvorijo 6 elementov drugega stolpca periodične tabele, ki sega od berilija (be) do radia (RA).
So skupina precej reaktivnih in razmeroma pogostih kovinskih elementov. Imata samo dva valenčna elektrona, ki se nahajata v orbitalu s. Zaradi tega pripadajo blokom s periodične tabele.
Ime "Alkalinoterreo" izvira iz zveze "alkalnih" besed, kar je še en način, kako izgovarjati osnovno, in Zemlja, tako so jim povedali pred oksidi. Tako alkalinoterne kovine dobesedno pomenijo kovine, ki tvorijo osnovne okside.
Te kovine imajo veliko aplikacij, zaradi katerih so pomembne v naši sedanji družbi, zlasti magneziju. Te aplikacije so posledica njihovih posebnih lastnosti, ki so opisane spodaj.
Lastnosti alkalinoternih kovin
Imajo kovinski videz
Vse alkalinoterne kovine imajo srebrno barvo s kovinsko svetlostjo. Radon je tudi radioaktiven, tako da v temni oddaja značilno zeleno svetlobo.
So majhne goste kovine
Vse alkalinoterne kovine so gostejše od vode, vendar so manj goste kot večina drugih kovinskih elementov v periodični tabeli.
Gostota v tej skupini se giblje od 1,54 g/cm3 Za kalcij do 5,5 g/cm3 Za radio, ki je bistveno manjša od gostote drugih kovin, kot je železo (7,9 g/cm3), baker (9,0 g/cm3), svinec (11,3 g/cm3) in El Mercurio (13,5 g/cm3), našteti jih nekaj, imenovati jih nekaj.
Imajo razmeroma nizke točke taljenja in vrelišča
Ker so kovine, so njene točke in vrelišča večje od večine ne -kovin. Vendar so nižje od fuzijskih in vrelišč večine drugih kovin, z nekaj izjemami.
Vam lahko služi: Arrheniusova enačbaImajo Valencia +2
Zaradi svoje elektronske konfiguracije te kovine ponavadi izgubijo dva elektrona, ko reagirajo z drugimi elementi, kot so ne -metali. Zaradi tega je njegova edina Valencia +2.
So relativno reaktivni
Alkalinoterne kovine so veliko bolj reaktivne kot kovine, kot sta železo ali baker, vendar so manj reaktivne kot alkalne kovine (elementi skupine 1). Nižja je skupina, bolj reaktivna je kovina.
Na primer, berilij (prvi v skupini) ne reagira z vodo, medtem ko lahko naslednji dve reagirajo z vročo vodo, zadnja.
Reagirati z zrakom, da tvori osnovne okside
Te kovine ponavadi tvorijo osnovne okside, ko reagirajo z zračnim kisikom. Pravzaprav se zato imenujejo alkalinerji. Ti oksidi, ko se raztapljajo v vodi, postanejo hidroksidi, ki proizvajajo alkalne ali osnovne rešitve.
Uporaba alkalinoternih kovin
V tehnološki industriji
Nekatere alkalinoterne kovine se uporabljajo pri proizvodnji polprevodnikov. Te so bistvene pri gradnji elektronskih vezij, kot so tisti, ki vsebujejo skoraj vse sodobne električne aparate, od računalnikov in mobilnih telefonov, do pralnih strojev, avtomobilov in drugih.
V živilski industriji
Kalcij je bistveno hranilo za življenje. Je del strukture kosti in ima druge pomembne funkcije v telesu. Zaradi tega je ta element dodan kot utrdba mnogim hrano od žit do mlečnih izdelkov. Poleg tega se uporablja tudi pri proizvodnji sira.
Lahko vam služi: Cirkonium: Zgodovina, lastnosti, struktura, tveganja, uporabeV avtomobilski industriji
Nekatere alkalinoterne kovine imajo zelo dobre mehanske lastnosti, kar pomeni, da so trde in odporne. Poleg tega so odporni na korozijo, zato se pogosto uporabljajo pri izdelavi luksuznih platišč za avtomobile in drugih delov.
V vojaški industriji
Zaradi mehanskih lastnosti in nizke gostote se pri gradnji bojnih letal, satelitov in helikopterjev uporabljajo kovine, kot sta magnezij in berilij.
Poleg tega se zaradi svojih električnih lastnosti uporabljajo tudi pri proizvodnji različnih vrst senzorjev in optičnih in elektronskih sistemov, ki jih vojaška industrija uporablja za ustvarjanje orožja in komunikacijskih sistemov.
Šest alkalnih kovin
Obstaja samo šest alkalnih kovin. Nato je na voljo kratek opis vsakega od njih:
Berlij (biti)
To je element 4 periodične tabele in prva skupina alkalinoternih kovin. To je zelo lahka, močna kovina z edinstvenimi lastnostmi, zaradi katerih je uporabna pri izdelavi polprevodnikov.
Magnezij (mg)
Magnezij je razmeroma lahka srebrna kovina, z nizko točko taljenja in vrelišča (v primerjavi z drugimi kovinami). Je zelo trda in odporna in se pogosto uporablja pri izdelavi avtomobilov in kot dodatek pri pripravi zlitin, kot so nekatere vrste jekla.
Gre. Tako kot drugi elementi v tej skupini je tudi to bistveno hranilo za življenje.
Kalcij (CA)
Kalcij je 5. najpogostejši element v Zemljini skorji. Najdemo ga kot kalcijev karbonat v številnih mineralih in kamninah in je tudi bistveni element za življenje zaradi njene udeležbe pri oblikovanju kosti in njegovega pomena v živčnem sistemu.
Vam lahko služi: stroncijev klorid (SRCL2)Ta kovina je element številka 20 periodične tabele, je v četrtem obdobju in je tretja alkalna kovina.
Stroncij (SR)
Element številka 38 in četrta alkalna kovina je stroncija. Je težji od kalcija, vendar se zdi veliko glede na svoje kemijske in fizikalne lastnosti. Pravzaprav lahko stroncij nadomesti kalcij v kosteh.
To je še posebej problematično, če se izpostavimo radioaktivni strontiju, ki se pojavi po jedrski reakciji.
Barium (BA)
Ta element ima atomsko številko 56 in ima tudi lastnosti, podobne lastnosti kalcija in stroncija. Je precej mehka in zelo reaktivna kovina, ki ni elementarna. Je ena izmed alkalinoternih kovin z večjim kovinskim značajem.
Radio (ra)
Zadnji element skupine Alcalinoterreos je radio, radioaktivna kovina (od tod tudi ime), ki oddaja rahlo zeleno svetlobo, ki jo je enostavno opazovati v temi.
Včasih so ga veliko uporabljali pri pripravi slik, ki sijejo v temi, a po odkritju nevarnosti zdravja je bila njegova uporaba prepovedana.

