Opredelitev atomske mase, vrste, kako jo izračunati, primeri
- 2168
- 508
- Stuart Armstrong
The atomska masa To je količina snovi, ki je prisotna v atomu, ki jo je mogoče izraziti v navadnih fizičnih enotah ali v atomskih masnih enotah (UMA ali U). Atom je prazen skoraj v celotni strukturi; Elektroni, ki so zamegljeni v regijah, imenovanih orbital, kjer obstaja določena verjetnost, da jih najdejo, in njihovo jedro.
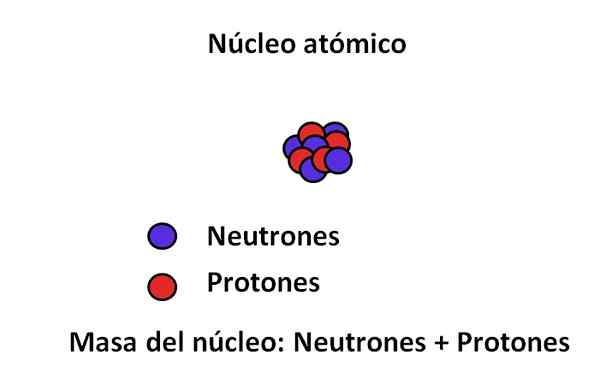
V jedru atoma so protoni in nevtroni; Prvi s pozitivnimi naboji, medtem ko sekunde z nevtralno obremenitvijo. Ta dva subatomska delca imata veliko večjo maso kot pri elektronu; Zato maso atoma ureja njegovo jedro in ne praznina ali elektroni.
 Glavni subatomski delci in masa jedra. Vir: Gabriel Bolívar.
Glavni subatomski delci in masa jedra. Vir: Gabriel Bolívar. Masa elektrona je približno 9,1 · 10-31 kg, medtem ko proton 1,67 · 10-27 kg, ki je masno razmerje 1.800; to pomeni, da proton "tehta" 1.800 -krat več kot elektron. Podobno se zgodi isto z masami nevtronov in elektronov. Zato se množični prispevek elektrona za običajne namene šteje za zanemarljiv.
Zaradi tega običajno domnevamo, da je masa atoma ali atomske mase odvisna le od mase jedra; ki pa je sestavljena iz vsote predmeta nevtronov in protonov. Iz tega sklepanja se pojavita dva koncepta: množično število in atomska masa, oba tesno povezana.
Če ima toliko "praznih" v atomih, in ker je njegova masa skoraj v celoti jedro, se pričakuje, da bo slednje izjemno goste.
Če bi to praznino vzeli v katero koli telo ali predmet, bi bile njegove dimenzije drastično. Če bi lahko zgradili majhen predmet, ki temelji na atomskih jedrih (brez elektronov), bi to imelo maso milijonov ton.
Po drugi strani atomske mase pomagajo razlikovati različne atome od istega elementa; To so izotopi. Če imam bolj obilne izotope kot drugi, je treba oceniti povprečje atomskih mas za določen element; povprečje, ki se lahko razlikuje od planeta na planetu ali iz ene vesoljske regije do druge.
[TOC]
Definicija in koncept

Po definiciji je atomska masa vsota mase njihovih protonov in nevtronov, izraženih z UMA ali U. Nastala številka (imenovana tudi masna številka) je v zgornjem levem kotu v zapisu, ki se uporablja za nukleide. Na primer za element petnajstX Njegova atomska masa je 15um ali 15U.
Atomska masa ne more povedati veliko o resnični identiteti tega elementa x. Namesto tega se uporablja atomska številka, kar ustreza protonom, ki so jedro x. Če je ta številka 7, bo razlika (15-7) enaka 8; to pomeni, da ima X 7 protonov in 8 nevtronov, katerih vsota je 15.
Vrnitev na sliko ima jedro 5 nevtronov in 4 protonov, tako da je njegova masna številka 9; In 9. uma je masa svojega atoma. S 4 protoni in posvetovanje s periodično tabelo je razvidno, da to jedro ustreza berilijevemu elementu 9Biti).
Atomska masna enota
Atomi so premajhni, da bi merili svoje mase z običajnimi metodami ali običajnimi lestvicami. Zaradi tega je bila izumljena UMA ali O DA (Daltón). Te enote, zasnovane za atome.
Vam lahko služi: kobalt: struktura, lastnosti, aplikacijeToda kaj točno predstavlja UMA? Obstajati mora referenca, ki vam omogoča vzpostavitev množičnih odnosov. Za to je bil atom uporabljen kot referenca 12C, ki je najpogostejši in stabilen izotop za ogljik. Ima 6 protonov (njihovo atomsko število z) in 6 nevtronov, njegova atomska masa je torej 12.
Domneva se, da imajo protoni in nevtroni iste mase, tako da vsak prispevek 1 UMA. Enota atomske mase je nato opredeljena kot dvanajstletni del (1/12) mase atoma ogljika-12; To je masa protona ali nevtrona.
Enakovrednost v gramih
In zdaj se pojavlja naslednje vprašanje: koliko gramov je enakovredno 1 UMA? Ker sprva ni bilo dovolj naprednih tehnik, da bi jo izmerili, so se morale kemikalije odločiti za izražanje vseh množic z UMA; Vendar je bila to prednost in ne pomanjkljivost.
Ker? Ker je majhna subatomska delca, tako kot otrok, mora biti njihova masa izražena v gramih. Pravzaprav je 1 UMA enakovredna 1.6605 · 10-24. 24 grams. Poleg tega z uporabo koncepta mol ni bil problem, da bi delali množice elementov in njihovih izotopov z UMA, saj vedo, da je mogoče takšne enote spremeniti v G/mol.
Na primer, vrnitev k petnajstX in 9BE, imamo, da sta njihovi atomski masi 15 UMA in 9 UMA. Ker so te enote tako majhne in ne povedo, koliko materije je treba "tehtati", da z njimi manipulirajo, se preoblikujejo v svoje molarne mase: 15 g/mol in 9 g/mol (uvajajo koncepte molov in avogadro).
Povprečna atomska masa
Nimajo vsi atomi istega elementa enake mase. To pomeni, da morajo imeti v jedru več subatomskih delcev. Ker je isti element, mora atomsko število ali število protonov ostati konstantno; Zato obstajajo le razlike v količini nevtronov, ki imajo.
Tako se pojavlja definicija izotopov: atomi istega elementa, vendar z različnimi atomskimi masami. Na primer, berilij skoraj v celoti sestavlja izotop 9Biti s sledovi sledi 10Biti. Vendar ta primer ne pomaga veliko pomaga razumeti koncepta povprečne atomske mase; Potrebujemo enega z več izotopi.
Primer
Recimo, da element obstaja 88J, to je glavni izotop J s 60%. J ima poleg tega še dva izotopa: 86J, z obilico 20%in 90J, z obiljem tudi 20%. To pomeni, da je od 100 j atomov, ki jih zbiramo na zemlji, 60 od njih 88J, preostalih 40 pa mešanica 86J in 90J.
Vsak od treh izotopov J ima svojo atomsko maso; to pomeni, da je vsota nevtronov in protonov. Vendar je treba te mase povprečno imeti, da bodo lahko atomi atomsko maso za j; tukaj na zemlji, saj so lahko druge regije vesolja, kjer je obilje 86J je 56% in ne 60%.
Vam lahko služi: natrij: zgodovina, struktura, lastnosti, tveganja in uporabeZa izračun povprečne atomske mase j je treba pridobiti tehtano povprečje mase njihovih izotopov; to pomeni, da upoštevamo odstotek številčnosti za vsakega od njih. Tako imamo:
Povprečna masa (j) = (86 UMA) (0,60) + (88 UMA) (0,20) + (90 UMA) (0,20)
= 87,2 UMA
To pomeni, da je povprečna atomska masa (znana tudi kot j 87,2 UMA. Medtem je njegova molarna masa 87,2 g/mol. Upoštevajte, da je 87,2 bližje 88 kot 86 in je tudi oddaljen od 90.
Absolutna atomska masa
Absolutna atomska masa je atomska masa, izražena v gramih. Iz primera hipotetičnega elementa lahko izračunamo njegovo absolutno atomsko maso (povprečje), vedoč, da je vsaka UMA enakovredna 1.6605 · 10-24. 24 Grami:
Absolutna atomska masa (j) = 87,2 UMA * (1,6605 · 10-24. 24 g/ uma)
= 1.447956 · 10-22 g/atom j
To pomeni, da imajo j atomi absolutno maso 1.447956 · 10-22 g.
Relativna atomska masa
Relativna atomska masa je enaka povprečni atomski masi za dani element; Vendar za razliko od drugega primanjkuje enotnosti. Zato je brezdimenzion. Na primer, povprečna atomska masa berilija je 9.012182 U; Medtem ko je njegova relativna atomska masa preprosto 9.012182.
Zato včasih ti koncepti običajno napačno razumejo kot sinonime, saj so zelo podobni in razlike med njimi so subtilne. Toda kakšne so te mase relativne? Glede na dvanajsti del mase 12C.
Tako element z relativno atomsko maso 77 pomeni, da ima maso 77 -krat večjo od 1/12 dela 12C.
Tisti, ki so si prislužili elemente v periodični tabeli, lahko vidijo, da se njihova masa izraža relativno. Nimajo UMA enot in ga razlagajo kot: Iron ima atomsko maso 55.846, kar pomeni, da je 55.846 -krat bolj masiven od mase 1/12 dela 12C, in to lahko izrazimo tudi kot 55.846 UMA ali 55.846 g/mol.
Kako izračunati atomsko maso
Matematično primer, kako ga izračunati s primerom elementa J. Na splošno je treba uporabiti tehtano povprečno formulo, ki bi bila:
P = σ (izotopna atomska masa) (številčnost v decimalih)
Z drugimi besedami, atomske mase (nevtroni + protoni) vsakega izotopa (navadne naravne) za določen element in njihovo kopensko številčnost (ali karkoli upoštevane regije).
In zakaj ne preprosto aritmetičnega povprečja? Na primer, povprečna atomska masa j je 87,2 UMA. Če bomo to maso znova izračunali, vendar na aritmetični način bomo imeli:
Povprečna masa (j) = (88 UMA + 86 UMA + 90 UMA)/3
= 88 UMA
Upoštevajte, da obstaja pomembna razlika med 88 in 87.2. To je zato, ker se v aritmetičnem povprečju domneva, da je številčnost vseh izotopov enaka; Ko so tri J izotope, mora imeti vsak obilje 100/3 (33,33%). Vendar v resnici ni: obstaja veliko bolj obilnih izotopov kot drugi.
Lahko vam služi: uretan: struktura, lastnosti, pridobivanje, uporabeZato se izračuna tehtano povprečje, saj se upošteva, kako obilno je izotop glede na drugega.
Primeri
Ogljik
Za izračun povprečne atomske mase ogljika potrebujemo njene naravne izotope s svojim številom. V primeru ogljika so to: 12C (98,89%) in 13C (1,11%). Relativne atomske mase sta 12 oziroma 13, ki sta enaka 12 UMA in 13 UMA. Reševanje:
Povprečna atomska masa (C) = (12 UMA) (0,9889) + (13 UMA) (0,0111)
= 12,0111 UMA
Zato je masa ogljikovega atoma v povprečju 12,01 UMA. S sledi zneska 14C, na to povprečje skoraj nima vpliva.
Natrij
Vsi kopenski atomi natrija so sestavljeni iz izotopa 23Ne, zato je njena številčnost 100%. Zato lahko v običajnih izračunih domnevamo, da je njegova masa preprosto 23 UMA ali 23 g/mol. Vendar je njegova natančna masa 22.98976928 UMA.
Kisik
Trije izotopi s kisikom z njihovimi številčnostmi so: 16O (99.762%), 17Ali (0,038%) in 18O (0,2%). Imamo vse za izračun njegove povprečne atomske mase:
Povprečna atomska masa (O) = (16 UMA) (0,99762) + (17 UMA) (0,00038) + (18 UMA) (0,002)
= 16.00438 UMA
Čeprav je njegova natančna masa poročala, je dejansko 15.9994 UMA.
Dušik
Ponavljanje istih korakov s kisikom imamo: 14N (99.634%) in petnajstN (0,366%). Tako:
Povprečna atomska masa (n) = (14 UMA) (0,99634) + (15 UMA) (0,00366)
= 14.00366 UMA
Upoštevajte, da je masa, poročana za dušik, 14.0067 UMA, nekoliko večja od tistega, kar izračunamo.
Klor
Izotopi klora z njihovimi številčnostmi so: 35Cl (75,77%) in 37CL (24,23%). Izračun njene povprečne atomske mase imamo:
Povprečna atomska masa (Cl) = (35 UMA) (0,7577) + (37 UMA) (0,2423)
= 35.4846 UMA
Zelo podobno poročilu (35.453 UMA).
Disposio
In končno, izračunana bo povprečna masa elementa z mnogimi naravnimi izotopi: disposio. Te in s svojim številom so: 156DY (0,06%), 158DY (0,10%), 160DY (2,34%), 161DY (18,91%), 162DY (25,51%), 163Dy (24,90%) in 164DY (28,18%).
Nadaljujemo kot prejšnji primeri za izračun atomske mase te kovine:
Povprečna atomska masa (dy) = (156 UMA) (0,0006%) + (158 UMA) (0,0010) + (160 UMA) (0,0234) + (161 UMA) (0,1891) + (162 UMA) (0,2551) + (163 UMA) (0,2490) + (164 UMA) (0,2818)
= 162.5691 UMA
Poročena masa je 162.500 UMA. Upoštevajte, da je to povprečje med 162 in 163, saj so izotopi 156Dy, 158Dy in 160Dy je malo obilnih; Medtem ko so tisti, ki prevladujejo 162Dy, 163Dy in 164Dy.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2019). Atomska masa. Pridobljeno iz: v.Wikipedija.org
- Christopher Masi. (s.F.). Atomska masa. Okrevano od: WSC.Masa.Edu
- Natalie Wolchover. (12. september 2017). Kako tehtate atom? Znanost v živo. Okrevano od: Livescience.com
- Kemija librettexts. (5. junij 2019). Izračunavanje atomskih mas. Okrevano od: kem.Librettexts.orki
- Edward Wichers in H. Steffen Peiser. (15. december 2017). Atomska teža. Encyclopædia Britannica. Okrevano od: Britannica.com
- « Značilnosti, učinki in aplikacije elektrokonvulzivne terapije
- Zgodovina embriologije, področje študija in veje »

