Lipasa karakateristična, struktura, vrste, funkcije
- 4808
- 368
- Ricky Dach
The lipasas Predstavljajo veliko družino encimov, ki lahko katalizirajo hidrolizo ester vezi, ki so prisotni v substratih, kot so trigliceridi, fosfolipidi, holesterol in nekateri vitamini.
Prisotni so praktično v vseh kraljestvih življenja, tako v mikroorganizmih kot v bakterijah in kvasovkah, kot pri rastlinah in živalih; V vsaki vrsti organizma imajo ti encimi posebne lastnosti in značilnosti, ki jih razlikujejo drug od drugega.
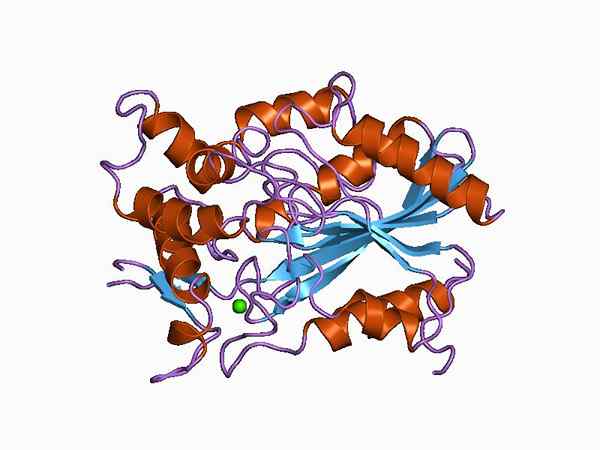
 Grafični prikaz molekularne strukture lipaze (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons)
Grafični prikaz molekularne strukture lipaze (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons) Glede na vrsto klasifikacije je mogoče razlikovati med "resničnimi" lipazami, znanimi tudi kot lipas triacilglicerol, in drugimi encimi s podobno lipolitično aktivnostjo, kot so fosfolipaza, esteraeuzni esterol in retinil-pealitate na mestu.
Prvo objavljeno poročilo o zaporedju encimske lipaze je bilo leta 1981 De Caro in sodelavce, ki so preučevali triacilglicerol lipasa trebušne slinavke prašičev. Naknadne študije so pokazale obstoj mnogih drugih sistemskih lipaz v živih organizmih.
Najpomembnejše lipaze pri živalih so prebavne lipaze, ki jih proizvajajo trebušna slinavka in jetra, ki sodelujejo pri presnovi maščob, ki jih redno zaužijemo, in imajo zato pomembne fiziološke posledice z različnih stališč.
Trenutno se ti encimi ne preučujejo samo za klinične in/ali presnovne namene, ampak tudi industrijsko proizvajajo za komercialne namene za predelavo hrane in druge izdelke, in jih je mogoče dobiti z gojenjem posebnih mikroorganizmov.
[TOC]
Značilnosti
Lipase so vodne topne beljakovine in katalizirajo hidrolitne reakcije v netopnih podlagah. V naravi jih najdemo v ravnovesju med njihovo aktivno obliko in njihovo neaktivno obliko in aktiviranje ali inaktivacija je odvisna od različnih notranjih notranjega dejavnika.
Vam lahko služi: glukani: struktura, značilnosti in funkcijeSpadajo v hidrolizazno encimsko družino z α/β pregibi, kjer so razvrščeni tudi mat, tioesterae, nekatere proteaze in peroksidaze, defalus in druge znotrajcelične hidrolaze.
Lipaze so kodirani z geni, ki spadajo v družino, ki vključuje kodirajoče gene trebušne slinavke, jetrno lipazo, lipoprotejsko lipazo, endotelno lipazo in fosfatidilserin fosfolipaza A1.
Katalitični mehanizem
Nekateri avtorji predlagajo, da je oblika katalize, ki jo imajo ti encimi, analogna obliki proteaz, ki je povezana s prisotnostjo treh posebnih aminokislinskih odpadkov na aktivnem mestu.
Mehanizem hidrolize pomeni tvorbo encimsko-substratnega kompleksa (lipaza: triglicerid), nato za nastanek hemiacetalnega posrednika in nato sproščanje diacilglicerida in maščobne kisline.
Zadnji korak hidrolize, sproščanje maščobnih kislin z aktivnega mesta, se zgodi po modelu, znanem kot model "katapult", kar pomeni katalitična.
Specifičnost substrata
Lipaze so lahko specifične in razlikujejo med substrati, kot so trigliceridi, diacilgliceridi, monogliceridi in fosfolipidi. Nekatere so specifične v maščobnih kislinah, torej glede na njihovo dolžino, stopnjo nasičenosti itd.
Lahko so selektivni tudi glede na regijo, kjer hidroliza katalizira, to pomeni, da imajo lahko pozicijsko specifičnost glede na mesto, na katerega so molekule maščobnih kislin povezane s okostjem glicerola (v katerem koli od treh karbonov).
Struktura
Kot tudi ostali člani encimske družine, ki jim pripadajo, je za lipaze značilna topologija, sestavljena iz α in β-nameščenih listov. Katalitično mesto teh encimov je na splošno sestavljeno iz triade aminokislin: serin, aspartična ali glutaminska kislina in histidin.
Vam lahko služi: avtopoezaVečina lipaz je glikoproteinov, ki imajo glede na velikost ogljikovega hidrata med 50 in 70 kDa molekulsko maso.
Človeška trebušna trebušna slinavka
Ima 449 aminokislinskih odpadkov in dve ločeni domeni: en N-terminal, kjer je katalitično mesto in značilen pregib hidrolaz (α/β) ter še en C-terminal, manjši in manjši in velja za "pomožno", s strukturo imenovan "sendvič β".
Njegova molekulska teža je med 45 in 53 kDa, njegova katalitična aktivnost pa je višja pri temperaturah blizu 37 ° C in pH med 6 in 10 in 10.
Funkcije
Na primer, odvisno od organa, kjer so pri sesalcih, lipaze izvajajo nekoliko drugačne fiziološke funkcije.
Kot rečeno, v trebušni slinavki, jetrih, jajčnikih in nadledvičnih žlezah (v ledvicah) in v endotelnih tkivih obstajajo posebne lipase.
Jetrne lipaze so odgovorne za presnovo lipoprotejskih delcev, ki so zapleteni z lipidi in beljakovinami, ki delujejo predvsem pri transportu trigliceridov in holesterola med organi in tkivi.
Konkretno, lipaze sodelujejo pri hidrolizi ali sproščanju maščobnih kislin iz molekul trigliceridov, ki jih vsebujejo lipoproteini. To je potrebno za pridobivanje energije iz teh molekul ali njihovo recikliranje, pri čemer jih uporabite kot predhodnike v sintezi drugih spojin.
Endotelne lipaze so prisotne v jetrih, pljučih, ščitnici in v reproduktivnih organih, izražanje njihovih genov pa urejajo različni citokini. Ti encimi sodelujejo tudi v presnovi lipoproteina.
Industrijske funkcije
V industriji proizvodnje mlečne hrane je uporaba lipaz pogosta za hidroliziranje maščob, prisotnih v mleku, kar neposredno vpliva na "potenciranje" okusa pri sirih, kremah in drugih mlečnih izdelkih.
Vam lahko služi: gliceraldehid 3-fosfat (G3P): struktura, funkcijeUporabljajo se tudi pri izdelavi drugih živilskih izdelkov, zlasti med fermentacijo, da bi izboljšali okus in "prebavljivost" nekaterih obrokov za pripravo hrane.
Daleč od prehrambene industrije je uporaba lipaz mikrobnega izvora priljubljena pri oblikovanju splošnih čistilnih detergentov in snovi, kar zmanjšuje škodljive učinke na okolje, ki vključuje ogromno kemijske obremenitve, ki je prisotna pri običajnih čistilnih produktih.
Reference
- Lowe, m. In. (2002). Trigliceridne lipaze trebušne slinavke. Journal of Lipid Research, 43, 2007–2016.
- Mead, j. R., Irvine, s. Do., & Ramji, D. Str. (2002). Lipoprotein lipaza: struktura, funkcija, regulacija in vloga pri bolezni. J. Mol. Med., 80, 753-769.
- Perret, b., Mabile, l., Martinez, l., Tretjič, f., Barbaras, r., & Collet, x. (2002). Jetrna lipaza: struktura / funkcionalna razmerja, sinteza in regulacija. Journal of Lipid Research, 43, 1163-1169.
- Santamarina-fojo, s., González-Navarro, h., Freeman, l., Wagner, e., Santamarina-fojo, s., Gonza, h.,... Nong, z. (2004). Jetrna lipaza, presnova lipoproteina in aterogeneza. Arterioskleroza, tromboza in vaskularna biologija, 24. 24, 1750-1754.
- Taylor, str., Kurtovic, i., Marshall, s. N., Zhao, x., Simpson, b. K., Kurtovic, i.,… Zhao, x. Yo. N. (2012). Lipaze sesalcev in rib. Ocene v ribolovu, 29, 37-41.
- « Nekoplanarni vektorji Opredelitev, pogoji, vaje
- Opredelitev, zapisovanje, vaje Equinecent Vectors »

