Avogadro zakon
- 652
- 150
- Miguel Gutmann DVM
Kaj je zakon Avogadro?
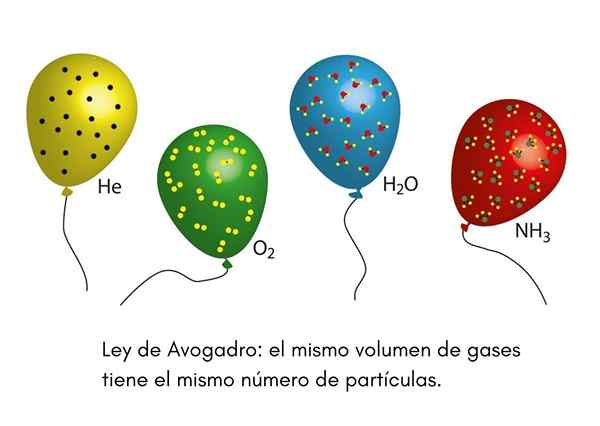
The Avogadro zakon, Imenuje se tudi načelo Avogadro, to je zakon, ki velja za idealne pline in ga je izrekel znanstvenik devetnajstega stoletja z imenom Amadeo Avogadro. Ta zakon določa, da bosta dva enaka količina različnih plinov, ki sta v enakih temperaturnih in tlačnih pogojih, vsebovala enako število plinastih delcev.
To pomeni, da če imamo dva balona, enega polnega s helijem, drugi pa s kisikom, in oba balona imata enak volumen, enak tlak in enako temperaturo, potem bo v prvem enako število plinastih atomov helija globus, ki ga molekule kisika v drugem.
Formula Avogadro Law
Drug način za določitev zakona Avogadro je reči, da bo prostornina plina, če se ohranjata konstanten tlak in temperatura, sorazmerna s številom molov. To je predstavljeno na matematičen način kot:
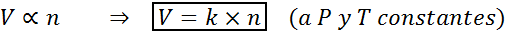
To formulo lahko preuredimo na v/n = k, to je, da razmerje med prostornino in številom molov ostane konstantno, kadar sta p in t konstantna.
Če torej uvedemo ali odstranimo določeno količino plina iz vsebnika, ki ohranja konstanto P in T, se bo glasnost spremenila, začetno in končno stanje pa bo povezano z naslednjo enačbo:

Pogoji, v katerih je izpolnjen zakon Avogadro
Ta zakon velja natančno za idealne pline. To so plini, ki jih tvorijo določeni delci (ki v prostoru ne zasedajo prostornine), ki na noben način ne delujejo.
Lahko vam služi: biodizel: zgodovina, lastnosti, vrste, prednosti, slabostiKot že ime pove, ta vrsta gaze ne obstaja v resnici, ampak v naši domišljiji. So poenostavljena "ideja" o tem, za kar verjamemo, da je plin. Vendar pa obstajajo nekateri pogoji, pod katerimi se v idealnem primeru obnaša pravi plin, na primer zrak: pri zelo nizkih pritiskih in pri zelo visokih temperaturah.
Nizki pritiski povzročajo, da je prostornina, ki jo zasedejo plinski delci, zanemarljiv v primerjavi z velikostjo posode, medtem ko visoke temperature delajo tako hitro, da nimajo časa za medsebojno delovanje.
V teh pogojih večina plinov z dobro natančnostjo izpolnjuje zakon Avogadro.
Pomen zakona Avogadro
Eden najpomembnejših prispevkov zakona Avogadro je bil, da je dovolil prikazati obstoj osnovnih plinov, ki jih tvori več kot en atom kot O2 ali h2. To je prispevalo k napredku atomske teorije.
Poleg tega zakon Avogadro dopolnjuje zakone Boyle, Charles in Gay-Lussac in ga združuje s temi tremi zakoni, zakon Avogadro omogoča zakon idealnih plinov, enega najpomembnejših zakonov v kemiji.
Po drugi strani zakon Avogadro omogoča tudi vzpostavljanje odnosov med molekulsko maso različnih plinov, saj pomeni, da je masa enakih količin različnih plinov, merjenih pri isti temperaturi in tlaku, sorazmerna z maso vsakega delca vsakega plina.
Vam lahko služi: natrijev nitrat (nano3): struktura, lastnosti, uporabe, tveganjaTako lahko z enim obžalovalnim vzorcem dveh plinov, ki zasedajo količino, enake enaki temperaturi in tlaku, dobimo razmerje med molarnimi masami.
Primeri zakona Avogadro v vsakdanjem življenju
Zabavni baloni
Že kdaj smo videli klovn na otroški zabavi, ki je napihnil helijeve balone, da bi jih razdelil med otroke. Ti baloni so pri približno enaki temperaturi. Če sta na enakem pritisku zapolnjena dva balona za zabave in sta oba enaka velikosti, zakon Avogadro zagotavlja, da bosta oba balona imela enako število helijskih molov.
Po drugi strani pa bo, če je eden od balonov večji od drugega, imel večji volumen in po zakonu Avogadro bo imel v notranjosti večjo količino helijevih delcev.
Pnevmatike avtomobila
Ne glede na to, kateri plini so napolnjeni, se pnevmatike na nasprotnih straneh avtomobila vedno napolnijo do enakega končnega tlaka okoli 32 psi.
Poleg tega vedno zagotavljamo, da sta obe gumi enaki, zato bosta imela enak glasnost. Tako lahko po načelu Avogadro rečemo, da bosta obe pnevmatiki vsebovali enako število plinastih delcev.
Brizga, polna zraka
Recimo, da imamo odprto brizgo in polno 50 cm3 zraka. Kot je odprta, sta notranjost brizge in zunanjost (okolica) pri enaki temperaturi in tlaku.
Predpostavimo, da pritisnemo bat brizge in ga premaknemo, dokler se ne odčita 10 cm3. Ko se brizga odkrije, zrak pobegne skozi konico, ko se bat premika, zato se število zračnih delcev znotraj brizge zmanjšu.
Vam lahko služi: hlapnostKer se tlak niti temperatura ne spreminjata, je mogoče uporabiti zakon Avogadro, da se končni volumen poveže s količino zračnih delcev, ki ostanejo znotraj brizge. Ta odnos je:

Če preuredimo to enačbo, to dobimo:
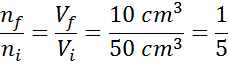
Ta rezultat pomeni, da bo, če zmanjšamo prostornino znotraj brizge na peto, ohranimo P in T konstantno, potem bo število molov ali delcev, ki so prisotni v notranjosti na koncu postopka.


