Dvojna reakcija nadomestitve
- 2223
- 610
- Don Nitzsche
Pojasnjujemo, kaj je dvojna nadomestitvena reakcija, vrste, ki obstajajo, in dajejo več primerov
Kaj je dvojna nadomestitvena reakcija?
The Dvojna reakcija nadomestitve, dvojnega premika ali metheze, je ena, v kateri se med dvema spojinama pojavi dvojna izmenjava ionov, brez kakršnih koli oksidiranih ali zmanjšanih. Predstavlja eno najbolj elementarnih kemičnih reakcij.
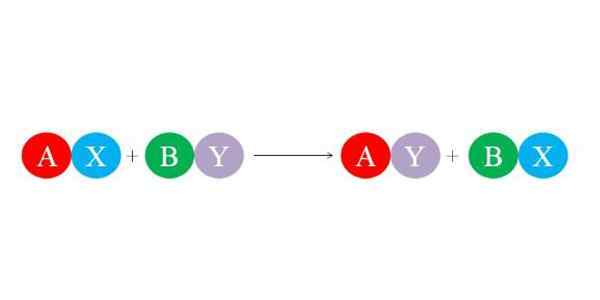
Nove povezave tvorijo velike sile elektrostatične privlačnosti med ioni. Prav tako reakcija daje prednost tvorbi najbolj stabilnih vrst, kot je molekula vode, predvsem. Na spodnji sliki je prikazana splošna kemična enačba za dvojno nadomestno reakcijo.

Začetne spojine sekira in z izmenjavo "njihovih partnerjev" in tako tvorijo dve novi spojini: AY in BX. Ta reakcija traja, če in samo, če sta E in sta bolj povezana kot A in B, ali če so povezave BX bolj stabilne kot tiste. Ker je reakcija preprosta ionska izmenjava, nobena od teh ne zmaga ali ne izgubi elektronov (redoks reakcija).
Če je A v spojini AX AX kation +1, bo imel enako obremenitev +1 v spojini AY. Enako velja za preostale "črke". Ta vrsta reakcije je podpora kislinskim in prepadnim reakcijam tvorbe.
Vrste dvojnih nadomestnih reakcij
Nevtralizacija
Močna kislina reagira z močno osnovo, da nastane topne soli in vode. Kadar je ena od dveh - kislina ali baza - šibka, proizvedena sol ni popolnoma ionizirana; to je v vodnem mediju, ki je sposoben hidroliziranja. Prav tako lahko kislino ali bazo nevtraliziramo s soljo.
Vam lahko služi: beril oksid (čebela)Zgoraj navedeno lahko znova predstavlja kemična enačba z Axby Letters. Ker pa Brønstedovo kislost kažejo le H ioni+ in oh-, Ti predstavljajo pisma na e y:
Hx + boh => hoh + bx
Ta kemična enačba ustreza nevtralizaciji, ki je preprosto reakcija med HX kislino in bazo BOH za proizvodnjo HOH (H2O) in BX sol, ki je morda topna ali ne v vodi.
Vaš okostje se lahko razlikuje glede na stehiometrične koeficiente ali naravo kisline (bodisi organsko ali anorgansko).
Padavine
Pri tej vrsti reakcije je eden od izdelkov netopen na sredini, na splošno vodni in obori (usedline trdne snovi preostale raztopine).
Shema je naslednja: dve topni spojini, sekira in z enim od izdelkov, AY ali BX, oborine, kar bo odvisno od pravil topnosti:
AX + by => ay (s) + bx
AX + by => ay + bx (s)
V primeru, da sta bila AY in BX netopna v vodi, bo to parilo ionov, ki predstavljajo najmočnejše elektrostatične interakcije, ki se lahko kvantitativno odražajo v njegovih konstantnih vrednostih topnosti (KPS).
Vendar je v večini padavinskih reakcij sol topna, drugi pa oborine. Obe reakciji - nevtralizacija in padavine - se lahko pojavijo v isti mešanici snovi.
Primeri dvojnih nadomestnih reakcij
Primer 1
HCl (AC) + NaOH (AC) => H2Ali (l) + NaCl (AC)
Kakšna reakcija je to? Klorovodikova kislina reagira z natrijevim hidroksidom, ki ustvarja vodo in natrijevim kloridom, posledično. Ker je NACL v vodnem mediju zelo topen in da je nastala tudi molekula vode, je reakcija primera 1 nevtralizacija.
Vam lahko služi: benzen: zgodovina, struktura, lastnosti, derivati, uporabePrimer 2
Žig3)2(Ac) + na2S (ac) => cus (s) + 2nano3(AC)
V tej reakciji niso prisotni niti ion h+ Niti oh-, In tudi molekula vode na desni strani kemične enačbe.
Bakreni nitrat (II) ali kuprak. Bakreni sulfid je netopen, oborino za razliko od natrijevega nitrata, soli topno.
Raztopina Cu (št3)2 Je modrikasto, medtem ko je2S je rumenkast. Ko sta oba mešana, barve izginejo in CUS obori, kar je črnina.
Primer 3
Pogl3COOH (AC) + NaOH (AC) => CH3Poon (AC) + H2Ali (l)
Spet je to še ena reakcija nevtralizacije. Ocetna kislina reagira z natrijevim hidroksidom, da tvori natrijev acetat sol in molekulo vode.
Za razliko od primera 1 natrijev acetat ni sol, ki je popolnoma ionizirana, saj je anion hidroliziran:
Pogl3COO-(Ac) + h2Ali (l) cho3COOH (AC) + OH-(AC)
Primer 4
2HI (AC) + Caco3(s) => h2Co3(ac) + cai2(AC)
V tej reakciji - ki čeprav se zdi, da ni nevtralizacija - iarhidrična kislina popolnoma reagira z apnencem, da ustvari ogljikovo kislino in kalcijev jodid. Poleg tega toplotni odvajanje (eksotermična reakcija) razgradi ogljikovo kislino v ogljikovem dioksidu in vodi:
H2Co3(ac) => co2(g) + h2Ali (l)
Globalna reakcija ostaja:
2HI (AC) + Caco3(s) => co2(g) + h2Ali (l) + cai2(AC)
Prav tako kalcijev karbonat, osnovna sol, nevtralizira iarklorovodikovo kislino.
Primer 5
Agno3(AC) + NaCl (AC) => Agcl (S) + Nano3(AC)
Vam lahko služi: Putrescina: struktura, lastnosti, sinteza, uporabaSrebrni nitratni izmenjava ionov z natrijevim kloridom, s čimer tvori netopno srebrno kloridno sol (bela oborina) in natrijev nitrat.
Primer 6
2H3Po4(AC) + 3CA (OH)2(Ac) => 6h2Ali (l) + ca3(Po4)2(S)
Fosforna kislina se nevtralizira s kalcijevim hidroksidom, kar posledično tvori netopno kalcijevo fosfatno sol in šest molov molekul vode.
To je primer dvojne nadomestne reakcije obeh vrst: nevtralizacija kisline in padavine netopne soli.
Primer 7
K2S (AC) + MGSO4(ac) => k2SW4(AC) + mgs (-e)
Kalijev sulfid reagira z magnezijevim sulfatom in se nabira v raztopinah s ioni2- in mg2+ Za tvorbo netopnega magnezijevega sulfida in soli topnega kalijevega sulfata.
Primer 8
Na2S (AC) + HCl (AC) → NACl (AC) + H2S (g)
Natrijev sulfid nevtralizira klorovodikovo kislino, ustvarja natrijev klorid in vodikov sulfid.
V tej reakciji se voda ne tvori (za razliko od najpogostejših nevtralizacij), ampak ne -električni molekulski vodikov sulfid, katerega vonj po gnilovih jajcih je zelo neprijeten. H2S se izogne raztopini v plinski obliki, preostala vrsta pa ostane raztopljena.

