Isóbaros
- 4989
- 141
- Cary Goyette
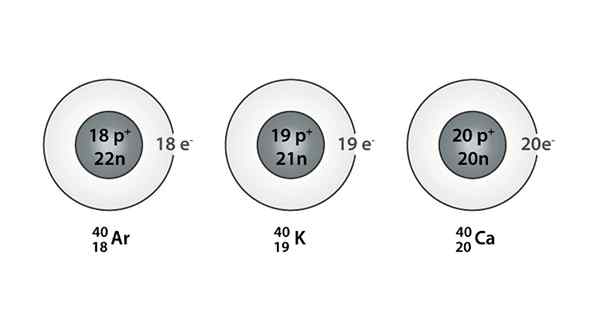
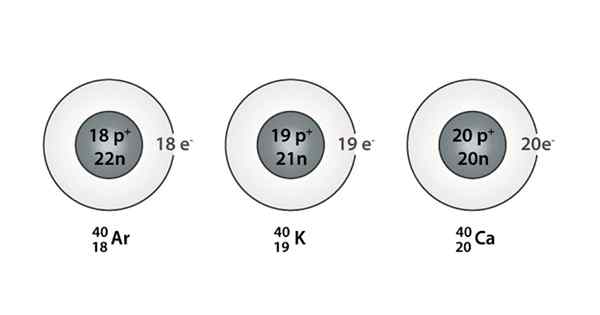 Primer Isóbaro; Argon, kalij in kalcij, ki imajo atome iste mase (40)
Primer Isóbaro; Argon, kalij in kalcij, ki imajo atome iste mase (40) Kaj so izoparos?
The Isóbaros To so tiste atomske vrste, ki imajo isto maso, vendar izvirajo iz različnih kemičnih elementov. Zaradi tega lahko rečemo, da jih sestavlja različno število protonov in nevtronov.
Tako protoni kot nevtroni so v jedru njihovih atomov, vendar neto količina nevtronov in protonov, prisotnih v vsakem jedru, ostaja enaka. Z drugimi besedami, vrsta Isóbara izvira, ko par atomskih jeder kaže enako neto število nevtronov in protonov za vsako vrsto.
Vendar je število nevtronov in protonov, ki predstavljajo ta neto znesek. Eden od načinov, kako opaziti, je opazovati masno številko (ki je nameščena na zgornji levi strani simbola zastopanega kemičnega elementa), ker je v izopijah ta številka enaka enaka.
Etimologija izraza Isóbaro izvira iz grških besed ISOS (kar pomeni "isto") in Baros (kar pomeni "teža"), ki se nanaša na enakost uteži med obema jedrskima vrstama.
Značilnosti izoparov
- Isoparos ohranjajo določene podobnosti z drugimi vrstami, katerih jedra predstavljajo naključja, kot je izotona, ki imajo enako količino nevtronov, vendar z različnim številom mase in 13C in 14Ne 36S in 37Cl.
- Izraz "nukleid" je poimenovanja, ki je bila skovana na vsak sklop nuklea (strukture, ki jih tvorijo nevtroni in protoni), ki jih je mogoče oblikovati. Tako da se nukleidi morda razlikujejo po številu nevtronov ali protonov ali celo po količini energije, ki jo ima struktura njegove konglomeracije.
Vam lahko služi: utekočinjanje: koncept, plini, tla in seizmični, semenski- Prav tako obstaja otroško jedro po β in ta proces je to izopar očetovega jedra, ker število nukleonov, prisotnih v jedru, ostane nespremenjeno, za razliko od tega, kar se zgodi s razpadom α.
- Pomembno si je zapomniti, da imajo različni Isóbaros različno atomsko število, kar potrjuje, da so različni kemični elementi.
Zastopanje
Za označevanje različnih nukleidov se uporablja določena zapis, ki jo je mogoče predstaviti na dva načina: ena je sestavljena iz postavitve imena kemičnega elementa, ki mu sledi njihova množična številka, ki ga združuje scenarij. Na primer: Nitrogen-14, katerega jedro je sestavljeno iz sedmih nevtronov in sedmih protonov.
Drugi način predstavljanja teh vrst je namestiti simbol kemičnega elementa, pred njim numerično zvezdo, ki označuje masno številko, ki jo ima zadevni atom, pa tudi numerični podpis, ki označuje njegovo atomsko številko, na naslednji način :
ZDoX
V tem izrazu X predstavlja kemični element zadevnega atoma, a je masna številka (rezultat dodajanja med količino nevtronov in protonov) in z predstavlja atomsko število (enako količino protonov v jedru atom).
Ko so ti nukleidi predstavljeni, se atomsko število atoma (z) običajno izpusti, ker ne podeljuje ustreznih dodatnih podatkov, zato je pogosto predstavljen kot DoX.
Eden od načinov za prikaz tega zapisa je, da vzamemo prejšnji primer (Nitrogen-14), ki je tudi označen kot kot 14N. To je zapis, ki se uporablja za izoboje.
Vam lahko služi: obsežne lastnosti snoviPrimeri Isóbarosa
Uporaba izraza "isóbaros" za vrste, znane kot nukleidi, ki imajo enako število nukleonov (enako masno število).
V tem vrstnem redu idej lahko opazimo primer izobojev v primeru vrste 14C in 14N: Masna številka je enaka 14, to pomeni, da je število protonov in nevtronov pri obeh vrstah drugačno.
Dejansko ima ta ogljikov atom atomsko število, ki je enako 6, zato je v svoji strukturi 6 protonov, v njej pa ima 8 nevtronov v svojem jedru. Potem je vaša masna številka 14 (6+8 = 14).
Atom dušika ima atomsko številko, ki je enaka 7, zato je sestavljena iz 7 protonov, vendar ima v svojem jedru 7 nevtronov. Vaša masna številka je tudi 14 (7+7 = 14).
Najdete lahko tudi serijo, v kateri imajo vsi atomi masno številko, ki je enaka 40; To je primer Isóbarosa: 40AC, 40K, 40Ar, 40Cl in 40S.
Razlike med izoto in izotopi
Nukleidi opisujejo različne vrste atomskih jeder, ki obstajajo glede na količino protonov in nevtronov, ki jih imajo.
Prav tako so med temi vrstami nukleidov izotropos in izotopi, ki se bodo razlikovali spodaj.
V primeru Isóbarosa, kot že omenjeno, imajo enako število nukleonov -to je isto masno število -kjer je število protonov, pri katerih je ena vrsta višje od druge primanjkljaj, tako da je skupna skupina enaka. Vendar je vaša atomska številka drugačna.
Lahko vam služi: kristaloidne rešitve: sestava, vrste in primeriV tem smislu izopične vrste prihajajo iz različnih kemičnih elementov, zato se nahajajo v različnih prostorih periodične tabele in imajo različne značilnosti in posebne lastnosti.
Po drugi strani pa se v primeru izotopov zgodi nasprotno, saj imajo enako atomsko število, vendar drugačno maso mase; to pomeni, da imajo enako število protonov, vendar različno število nevtronov znotraj svojih atomskih jeder.
Poleg tega so izotopi atomske vrste, ki pripadajo istim elementom, zato se nahajajo v istem prostoru v periodični tabeli in imajo podobne značilnosti in lastnosti.

