Hidrofobne interakcije, kar je pomembno, primeri
- 1209
- 6
- Adrian Legros
The Hidrofobne interakcije (HI) So sile, ki ohranjajo kohezijo med apolarnimi spojinami, potopljenimi v polarno raztopino ali topilo. Za razliko od drugih nekovalentnih interakcij, kot so vodikovi mostovi, ionske interakcije ali sile van der Waals.
Zelo ilustrativni primer teh interakcij je lahko fazna ločitev, ki se pojavi pri mešanju vode z oljem. V tem primeru se molekule olja "medsebojno medsebojno medsebojno spopadajo kot rezultat urejanja molekul vode okoli njih.
 Emulzija maščobe v vodi (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons)
Emulzija maščobe v vodi (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons) Pojem teh interakcij obstaja že pred štiridesetimi. Vendar je izraz "hidrofobna povezava" skoval Kauzmann leta 1959, medtem ko je preučeval najpomembnejše dejavnike pri stabilizaciji tridimenzionalne strukture nekaterih beljakovin.
Njegovi so najpomembnejše nespecifične interakcije, ki potekajo v bioloških sistemih. Prav tako imajo pomembno vlogo pri različnih inženirskih aplikacijah in kemični in farmacevtski industriji, ki jih poznamo danes.
Vzrok hidrofobnih interakcij
Fizični vzrok njegovega temelji na nezmožnosti apolarnih snovi oblikovanja vodikovih vezi z molekulami vode v raztopini.
Znani so kot "nespecifične interakcije", saj niso povezane z afiniteto med molekulami topljencev, temveč s težnjo molekul vode do vzdrževanja lastnih interakcij s pomočjo vodikovih vezi.
Vam lahko služi: biosurfaktantiPo stiku z vodo se apolarni ali hidrofobne molekule ponavadi dodajajo spontano, da dosežejo večjo stabilnost z zmanjšanjem območja kontaktne površine z vodo.
Ta učinek bi lahko zamenjali z močno privlačnostjo, vendar to ni nič drugega kot posledica apolarnega značaja snovi glede na topilo.
Pojasnjeno s termodinamičnega vidika se te spontane povezave pojavljajo v iskanju energijsko ugodnega stanja, kjer imate najmanj brezplačno spreminjanje energije (∆G).
Ob upoštevanju tega ∆G = ∆H - T∆S, Najbolj energično ugodno stanje bo tisto, kjer je entropija (∆S) Bodite večji, torej tam, kjer je manj molekul vode, katerih rotacijska in translacijska svoboda se zmanjša s stikom z apolarnim topilom.
Ko so apolarne molekule povezane med seboj, prisiljene z molekulami vode, dobimo ugodnejše stanje, kot če bi te molekule ostale ločene, vsaka obdana s "kletko" različnih molekul vode.
Biološki pomen
Njegovi imajo velik pomen, saj se pojavljajo v raznolikosti biokemijskih procesov.
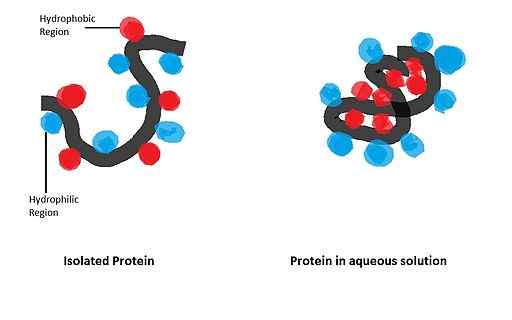
Med temi procesi so konformacijske spremembe v beljakovinah, zveza encimskih substratov, povezanost podenot encimskih kompleksov, združevanje in tvorba bioloških membran, stabilizacija beljakovin v vodnih raztopinah in drugih.
Kvantitativno so različni avtorji dali nalogo, da določijo, kakšen pomen je v stabilnosti strukture velikih količin beljakovin, in sklepali, da te interakcije prispevajo k več kot 50 %.
Lahko vam služi: glukoza oksidaze: značilnosti, struktura, funkcijeŠtevilni membranski beljakovini (integralni in periferni) so povezani z lipidnimi dvosloji, zahvaljujoč HI, ko imajo v svojih strukturah ti proteini hidrofobne domene. Poleg tega je stabilnost terciarne strukture številnih topnih beljakovin odvisna od HI.
Nekatere tehnike pri preučevanju celične biologije izkoriščajo lastnost, ki jo nekateri ionski detergenti POS.
MICELS se uporabljajo tudi v farmacevtskih študijah, ki vključujejo dostavo maščobnih topnih zdravil, njihova tvorba pa je bistvenega pomena tudi za absorpcijo kompleksnih vitaminov in lipidov v človeškem telesu.
Primeri hidrofobnih interakcij
Membrane
Odličen primer HI je tvorba celičnih membran. Takšne strukture so sestavljene iz dvoslojnih fosfolipidov. Vaša organizacija se daje zahvaljujoč se njegovim, ki se pojavljajo med apolarnimi repi v "odbojnosti" v okoliško vodno okolje.
Beljakovine
Njegov velik vpliv na zlaganje krogličnih beljakovin, katerih biološko aktivna oblika dobimo po vzpostavitvi določene prostorske konfiguracije, ki jo ureja prisotnost nekaterih aminokislinskih odpadkov v strukturi.
- Primer apomioglobina
Apomikoglobin (mioglobin, ki mu primanjkuje hemo skupine), je majhen alfa-helikoidni protein, ki je služil kot model za preučevanje procesa zlaganja in pomen njegovega med apolarnimi odpadki v polipeptidni verigi iste.
V študiji, ki so jo izvedli Dyson in sodelavci leta 2006, kjer so bile uporabljene mutirane sekvence apomioglobina, se je pokazalo, da je začetek tega zložljivega dogodka odvisen predvsem od njegovih aminokislin z aminokislinami z apolarnimi skupinami alfa-helices.
Lahko vam služi: razmerje med snovjo in energijo, opaženo pri prehrani celicTako majhne spremembe, vnesene v zaporedje aminokislin, pomenijo pomembne spremembe v terciarni strukturi, kar ima za posledico slabo oblikovane in neaktivne beljakovine.
Detergenti
Drug njegov jasen primer je način delovanja komercialnih detergentov, ki jih vsak dan uporabljamo za domače namene.
Detergenti so amfipatične molekule (s polarno regijo in drugim apolarom). Lahko "emulgirajo" maščobo, saj imajo možnost tvorjenja vodikovih vezi z molekulami vode in imajo hidrofobne interakcije z lipidi, prisotnimi v maščobah.
Po stiku z maščobo v vodno raztopino so molekule detergenta med seboj povezane tako, da se apolarni repi soočajo, in obdajajo lipidne molekule in so izpostavljeni površini micele polarne regije, ki vstopajo v kontakt z vodo.
Reference
- Chandler, d. (2005). Vmesniki in gonilna sila hidrofobnega sklopa. Narava, 437(7059), 640–647.
- Dyson, J. H., Wright, str. In., & Sheraga, h. Do. (2006). Vloga hidrofobnih interakcij pri iniciaciji in širjenju zlaganja beljakovin. PNAS, 103(35), 13057-13061.

