Indijanca

- 983
- 188
- Don Nitzsche
 Kovinski indijski kos. Vir: Hi-Res Slike kemičnih elementov [cc by (https: // creativeCommons.Org/licence/by/3.0)]
Kovinski indijski kos. Vir: Hi-Res Slike kemičnih elementov [cc by (https: // creativeCommons.Org/licence/by/3.0)] Kaj je Indijanec?
On Indijanca Je kovina, ki spada v skupino 13 periodične tabele in ima kemični simbol v. Vaša atomska številka je 49, 49V in je v naravi predstavljen kot dva izotopa: 113V in 115V slednji je najpogostejši. Na Zemlji se indijske atome najdemo kot nečistoče v cinku in svinčevih mineralih.
To je posebna kovina, saj je najmehkejša, ki se je lahko dotaknete brez številnih zdravstvenih tveganj; Za razliko od litija in rubidija, ki bi kožo strašno zažgal, ko reagira z vlago. Košček Indijca je mogoče razrezati z nožem in zlomom s silo prstov, kar oddaja izrazito drobljenje.
Kdor sliši za to kovino, bo zagotovo prišel na misel v Indijo, vendar njegovo ime izhaja iz barve Indigo, kar opažamo, ko se izvaja plamen. V tem smislu je videti precej kalija, kovine ali spojin je zažgal z zelo značilnim plamenom, skozi katerega so Indijca prvič odkrili v Sphenset Minerals.
Indijanca deli številne kemijske lastnosti z aluminijem in galijem, v večini spojin pa predstavlja oksidacijsko število +3 (v in v3+). Odlično združuje z zlitinami Gaul z nizkimi talnimi točkami, ena od njih je Galinnstan.
Indijske aplikacije temeljijo na oblogi materialov s svojimi zlitinami, zaradi česar so električni in prilagodljivi vodniki. Indijanec ima nekaj kozarca, da jim podeli večje bleščice, nadomešča srebro. V svetu tehnologije je Indijanca na zaslonih na dotik in LCD.
Odkritje
Leta 1863 je nemški kemik Ferdinand Reich iskal sledi talio elementa z uporabo zelene črte svojega spektra emisij v mineralih Cinc; Konkretno vzorci sfalerita (ZN) okoli Saške. Po nazdravljanju mineralov odstranite njihovo vsebnost žvepla, jih prebavite v klorovodikovo kislino in destilirali cinkov klorid, dobite pajizo oborino.
Glede na ugotovitev se je Reich odločil izvesti spektroskopsko analizo; Ker pa ni imel dobrih oči, da bi opazoval barve, je šel k kolegu Hariomusu Theodorju Richterju, da bi mu pomagal pri tej nalogi. Richter je bil tisti, ki je opazoval modrikasto spektralno črto, ki se ni ujemala s spektrom nobenega drugega elementa.
Lahko vam služi: jodozna kislina (HIO2): lastnosti in uporabeDva nemška kemika sta se soočila z novim elementom, ki se je imenovala indijska barva za indigo barvo plamena, ko so njihove spojine gorele; In ime te barve izhaja iz latinske besede Indicum, Kaj pomeni Indija.
Leto kasneje, leta 1864, so bili navdušeni in po dolgotrajni seriji padavin in čiščenja izolirali vzorec kovinskega Indijca z elektrolizo njihovih raztopljenih soli v vodi.
Indijska struktura
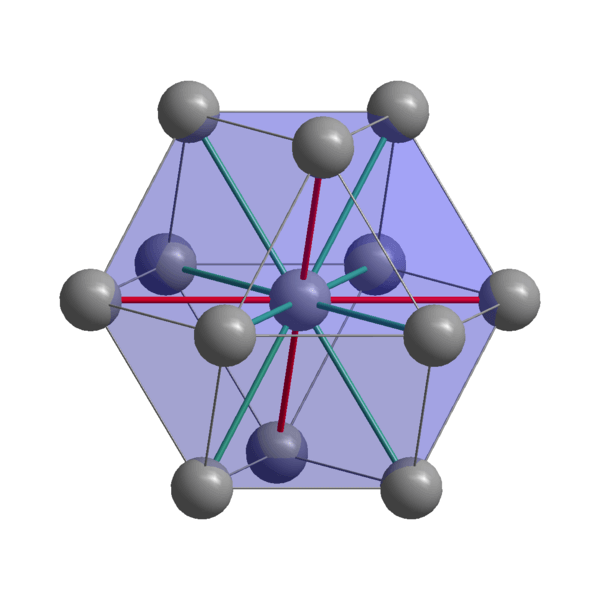 Indijska kristalna struktura
Indijska kristalna struktura Indijski, kohezijski atomi, ki uporabljajo svoje valenčne elektrone za vzpostavitev kovinske vezi. Tako so na koncu urejeni v izkrivljeni tetragonalni strukturi, osredotočeni na telo. Interakcije med atomi v in v sosednjem in v sosednjem sorazmerno šibke, kar pojasnjuje, zakaj ima Indijanec nizko tališče (156 ° C).
Po drugi strani pa sile, ki združujejo dva ali več indijskih kristalov, tudi niso močne, sicer se ne bi premikale drug na drugega in podelile značilno mehkobo kovine.
Indijske lastnosti
Fizični videz
Je izjemno mehka srebrna kovina. Se lahko raztrga s pritiskom nohta, razreže z nožem ali praska v svetlih potezah na listu papirja. Možno ga je celo žvečiti in deformirati z zobmi, pod pogojem. Je tudi zelo duktilna in povišana, s plastičnimi lastnostmi.
Ko se Indijanec segreje z baklo, zavrne plamen indigo barve, še svetlejše in bolj barvito kot kalij.
Molarna masa
114,81 g/mol
Tališče
156,60 ° C
Vrelišče
2072 ° C.
Tako kot Gaul ima tudi Indijanec velik temperaturni interval med fuzijsko točko in vrenjem. To odraža dejstvo, da so interakcije v tekočini močnejše od tistih, ki prevladujejo v kozarcu; In zato je lažje pridobiti kapljico indijske kot njihove hlape.
 Indijska lokacija v periodični tabeli. Vir: Daniel Mayer ali Greatpatton Vectorizacija: Sushant Savla, CC BY-SA 3.0, prek Wikimedia Commons
Indijska lokacija v periodični tabeli. Vir: Daniel Mayer ali Greatpatton Vectorizacija: Sushant Savla, CC BY-SA 3.0, prek Wikimedia Commons Gostota
Pri sobni temperaturi: 7,31 g/cm3
Desno na tališču: 7,02 g/cm3
Elektronegativnost
1,78 na lestvici Pauling
Ionizacijske energije
Prvi: 558,3 kJ/mol
Drugi: 1820,7 kJ/mol
Tretjič: 2704 kJ/mol
Toplotna prevodnost
81,8 w/(m · k)
Električna upornost
83,7 nω · m
Mohs trdota
1.2. Je komaj malo težje kot talc (ne zmedeno trdost).
Reaktivnost
Indijanec se v kislinah raztopi, da povzroči soli, vendar se ne raztopi v alkalnih raztopinah, tudi z vročim kalijevim hidroksidom. Reagira v neposrednem stiku z žveplom, kisikom in halogeni.
Vam lahko služi: redčenje: koncept, kako je to, primeri, vajeIndijanec je relativno amfoteričen, vendar se obnaša bolj kot osnova kot kislina, saj so njene nekoliko osnovne vodne rešitve. V (OH)3 Ponovno se spreminja z dodatkom več alkalijev, ki povzročajo indiate komplekse, v (OH)4-, Kot pri aluminatih.
Elektronska konfiguracija
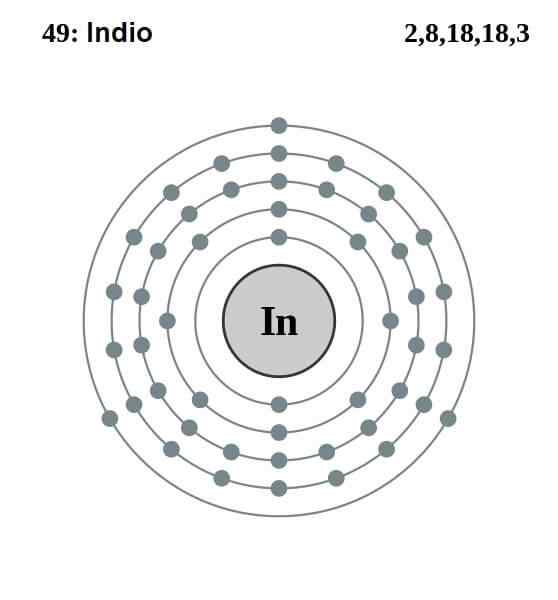 Elektronska indijska konfiguracija
Elektronska indijska konfiguracija Elektronska konfiguracija Indijca je naslednja:
[KR] 4d10 5s2 5 str1
Od teh trinajstih elektronov so zadnje tri od 5 -ih in 5p orbital tistega iz Valencije. S temi tremi elektroni indijski atomi vzpostavljajo svojo kovinsko vez, kot to počneta aluminij in galij, in tvorijo kovalentne vezi z drugimi atomi.
Oksidacijske številke
Zgoraj se uporablja za stališče, da lahko Indijanec izgubi svoje tri elektrone Valencije ali osvoji pet, da postane izolektronski do plemenitega plina ksenona.
Če v spojini predvidevamo, da je izgubil svoje tri elektrone, bo ostal kot trivalentna kation v3+ (V analogiji al3+ in ga3+) in zato bo vaša oksidacijska številka +3. Večina indijskih spojin je v (iii).
Med drugimi oksidacijskimi številkami, ki jih najdemo za Indijca, imamo: -5 (in5-), -2 (v2-), -1 (v-), +1 (v+) in +2 (v2+).
Nekaj primerov spojin v (i) je: inf, vklj, inbr, ini in v2Tudi. Vse so razmeroma redke spojine, medtem ko prevladujejo tiste v (iii): v (OH)3, V2Tudi3, V biktno3, Inf3, itd.
V (i) spojinah so močna sredstva za redukcije, v katerih je+ Dve elektroni podarite drugim vrstam, da postanejo v3+.
Izotopi
Indijanec je v naravi predstavljen kot dva izotopa: 113V in 115V, katerih obilje zemlje je 4,28% oziroma 95,72%. Zato imamo na Zemlji še veliko več atomov 115V 113V. On 115In ima pol življenja 4,41 · 1014 leta, tako velika, da se praktično šteje za stabilno, čeprav je radioizotop.
Trenutno je bilo ustvarjenih skupno 37 umetnih izotopov indijskih, vseh radioaktivnih in zelo nestabilnih. Od vseh je najbolj stabilen 111V, ki ima pol življenja 2,8 dni.
Uporaba/aplikacije
Zlitine
Indijanec se zelo dobro razume z galijem. Obe kovini tvorita zlitine, ki melu. Tudi Indijanca je tudi zlahka združena, saj ima 57 -odstotno topnost v Merkurju.
Vam lahko služi: ocetna kislina (CH3COOH)Indijske zlitine se uporabljajo za oblikovanje srebrnih ogledal, ne da bi se zatekli v srebro. Ko jih nalijejo na območje katerega koli materiala, deluje kot privržen, tako da se lahko zbirajo steklo, kovino, kremen in keramiko.
Elektronika
 Brez Indijca zasloni na dotik nikoli ne bi obstajali
Brez Indijca zasloni na dotik nikoli ne bi obstajali Indijanec se tudi sprijazni z Germanio, zato se njegove spojine dodajo kot doping v germanski nitruro LED, ki reproducirajo te mešanice modre luči, vijolične in zelene. Je tudi del tranzistorjev, termistorjev in fotovoltaičnih celic.
Najpomembnejša od njegovih spojin je kositer in indijski oksid, ki se uporablja kot steklena obloga, da odraža nekatere valovne dolžine. To vam omogoča, da se uporabljate v kozarcih za varjenje in v steklu za praske, da se v notranjosti ne segrejejo.
Stekleno prevlečeno s tem oksidom so dobri električni vodniki; Kot tisti s prstov. In zato je namenjen izdelavi zaslonov na dotik, še bolj trenutne dejavnosti zaradi nastanka vedno več pametnih telefonov.
Tveganja
 Indijanec v trdnem stanju. Vir: w. Oelen, cc by-sa 3.0, prek Wikimedia Commons
Indijanec v trdnem stanju. Vir: w. Oelen, cc by-sa 3.0, prek Wikimedia Commons Indijanec ne predstavlja nobenega tveganja za okolje na prvi stopnji, kot je v ioni v3+ Ne razširjajo se v pomembnih količinah. Ni podatkov o tem, kakšen bi vplival na tla, ki vplivajo na rastline in niti v favni ali morju.
V telesu ni znano, ali so ioni v3+ Imajo nekaj bistvenega sodelovanja v presnovi v sledovih. Ko pa se njihove spojine zaužijejo, so škodljive za več organov, zato veljajo za zelo strupene snovi.
Dejansko so delci ITO (kositer in indijski oksid, za svojo kratico v angleščini: Indijev kositer oksid), nepogrešljivo za izdelavo zaslonov za računalnike in pametne telefone, lahko negativno vplivajo na zdravje delavcev, kar jim povzroči bolezen, imenovano indijska pljuča.
Vnos teh delcev se zgodi predvsem z vdihavanjem in stikom skozi kožo in oči.
Po drugi strani so fini kovinski indijski delci nagnjeni k gori in povzročajo požare, če so ograje vir toplote.

