Živosrebrni hidroksidni struktura, lastnosti, uporabe, tveganja
- 2034
- 264
- Raymond Moen
On Živo srebro hidroksid Gre+. Njegova kemična formula je HG (OH)2. Vendar ta vrsta še ni bila pridobljena v trdni obliki v normalnih pogojih.
Živo srebro ali živosrebrni hidroksid hidroksid je prehodni kratki življenjski posrednik pri tvorbi HGO živahnega oksida v alkalni raztopini. Za študije, izvedene v raztopinah HGO Mercuric Oxide, je bilo ugotovljeno, da je HG (OH)2 Je šibka podlaga. Druge vrste, ki ga spremljajo, so hgoh+ in Hg2+.
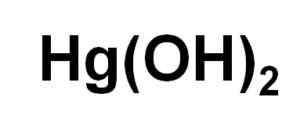 Kemična formula živega srebra hidroksida (II). Avtor: Marilú Stea.
Kemična formula živega srebra hidroksida (II). Avtor: Marilú Stea. Kljub temu, da ga ne moremo oboriti v vodni raztopini, HG (OH)2 Dobili smo ga s fotokemično reakcijo živega srebra z vodikom in kisikom pri zelo nizkih temperaturah. Pridobljeno je bilo tudi v obliki soprecipitirane skupaj z vero (OH)3, kjer prisotnost haluro ionov vpliva na pH, v katerem se pojavlja soprecipitacija.
Ker na laboratorijski ravni ni zlahka dosegel čistega, ni bilo mogoče najti pripomočka za to spojino ali določiti tveganj njegove uporabe. Vendar je mogoče ugotoviti, da predstavlja enaka tveganja kot druge spojine za živo srebro.
[TOC]
Struktura molekul
Struktura živega srebra hidroksida (II) HG (OH)2 Temelji na linearnem osrednjem delu, ki ga tvori atom živega srebra z dvema atoma kisika na strani.
Atomi vodika so združeni s to osrednjo strukturo, vsaka poleg vsakega kisika, ki se prosto obrne okoli vsakega kisika. Lahko bi ga predstavljali na preprost način, kot je navedeno spodaj:
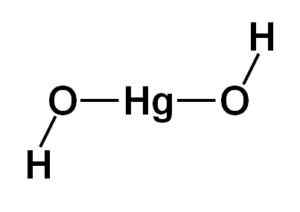 Teoretična struktura živega srebra hidroksida (II). Avtor: Marilú Stea
Teoretična struktura živega srebra hidroksida (II). Avtor: Marilú Stea Elektronska konfiguracija
Elektronska struktura kovinskega živega srebra HG je naslednja:
[Xe] 5d10 6s2
kjer je [xe] elektronska konfiguracija plemenitega plina ksenona.
Pri opazovanju te elektronske strukture je izpeljano, da je najbolj stabilno oksidacijsko stanje živega srebra tisto, kjer se izgubita 2 elektrona plasti 6s.
V HG (OH) Mercuric hidroksid2, Atom živega srebra (HG) najdemo v njegovem oksidacijskem stanju 2+. Zato v HG (OH)2 Merkur ima naslednjo elektronsko konfiguracijo:
Lahko vam služi: 30 uporabe karboksilnih kislin v vsakdanjem življenju[Xe] 5d10
Nomenklatura
- Živo srebro hidroksid (ii)
- Mercuric hidroksid
- Živo srebro dihidroksid
Lastnosti
Molekularna teža
236,62 g/mol
Kemične lastnosti
Po posvetovanih informacijah je možno, da HG (OH)2 Biti prehodna spojina pri tvorbi HGO v alkalnem vodnem mediju.
Dodatek hidroksilnih ionov (OH-) do vodne raztopine z živahnimi ioni Hg2+ Vodi do padavin rumenega trdnega živega oksida (II) HGO, od tega Hg (OH)2 Je potnik ali začasni agent.
 Živo srebro oksid (ii). Leiem [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons.
Živo srebro oksid (ii). Leiem [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons. V vodni raztopini Hg (OH)2 Je zelo kratek življenjski posrednik, saj hitro sprosti molekulo vode in obori trdno HGO.
Čeprav ni bilo mogoče oboriti merkurnega hidroksida HG (OH)2, Živosreni oksid (II) HGO je nekaj topnega v vodi, ki tvori raztopino vrst, imenovane "hidroksidi".
Te vrste v vodi, imenovane "hidroksidi", so šibke podlage in čeprav se včasih obnašajo kot amfotorati, na splošno HG (OH)2 Je bolj osnovna kot kislina.
Ko se HGO raztopi v HClO4 Študije kažejo na prisotnost merkurnega iona HG2+, HGOH monohidroximurcuro ion+ in HG (OH) Mercuric hidroksid2.
Stanja, ki se pojavljajo v takšnih vodnih raztopinah, so naslednja:
Hg2+ + H2Ali ⇔ hgoh+ + H+
Hgoh+ + H2Ali ⇔ hg (OH)2 + H+
V alkalnih raztopinah NaOH se oblikuje vrsta hg (OH)3-.
Pridobivanje
Čisti živosrebrni hidroksid
Živo srebro hidroksid (ii) HG (OH)2 Ni ga mogoče dobiti v vodni raztopini, ker z dodajanjem alkalij v raztopino HG trgovskih ionov2+, obori rumeno živahni oksid.
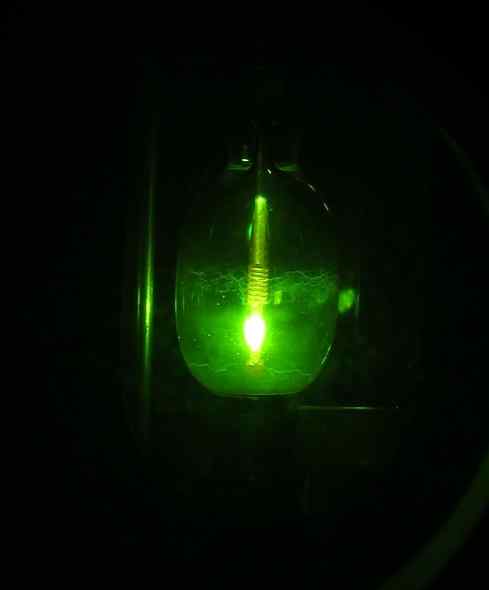
Vendar pa je nekaterim raziskovalcem uspelo pridobiti leta 2005 prvič HG (OH) Mercuric hidroksid2 Uporaba žarnice živega srebra, začenši z elementa Mercury HG, vodik H2 in kisik oz2.
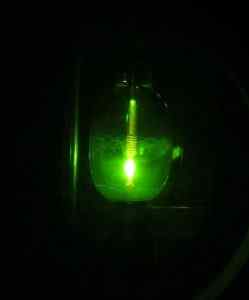 Živosrebrna svetilka. D-kuru [cc by-sa 2.0 at (https: // createCommons.Org/licence/by-sa/2.0/at/Deed.v)]. Vir: Wikipedia Commons.
Živosrebrna svetilka. D-kuru [cc by-sa 2.0 at (https: // createCommons.Org/licence/by-sa/2.0/at/Deed.v)]. Vir: Wikipedia Commons. Reakcija je fotokemična in je bila izvedena v prisotnosti neona, argona ali trdnega devterija pri zelo nizkih temperaturah (približno 5 k = 5 stopinj Kelvina). Dokazi o tvorbi spojin so bili pridobljeni z IR spektri absorpcije svetlobe (infrardeči).
Vam lahko služi: oborinoHG (OH)2 Na ta način je pripravljen zelo stabilen pod pogoji izkušenj. Ocenjujejo, da fotokemična reakcija poteka skozi posrednik O-HG-O do stabilne molekule H-O-HG-O-H.
Koprecipitacijo z železnim hidroksidom (III)
Če se živo srebro sulfat (ii) HGSO raztopi4 in železov sulfat (iii) vera2(SW4)3 V vodni raztopini kisline in pH se začne povečevati z dodajanjem NaOH natrijevega hidroksida2 in vera (oh)3.
Ugotovljeno je bilo, da tvorba HG (OH)2 To je ključni korak v tem soglasju z vero (OH)3.
Oblikovanje HG (OH)2 V vera oborine (OH)3-HG (OH)2 Močno je odvisno od prisotnosti ionov, kot so fluorid, klorid ali bromid, od specifične koncentracije le -teh in pH raztopine.
V prisotnosti fluorida (f-), PH, večji od 5, soprecipitacija HG (OH)2 Z vero (OH)3 ni prizadeti. Toda na pH 4 tvorba kompleksov med HG2+ in f- vmešava v soglasje HG (OH)2.
V primeru prisotnosti klorida (Cl-), Soprecipitacija HG (OH)2 Pojavi se na pH 7 ali več, torej v alkalnem mediju.
Ko je bromid prisoten (Br-), Soprecipitacija HG (OH)2 Zdi se pri še večjem pH, torej pH nad 8,5 ali bolj alkalnim kot s kloridom.
Prijave
Iz pregleda razpoložljivih virov informacij izhaja, da je živosrebrni hidroksid (ii) HG (OH)2, Ker je spojina, ki še ni pripravljena na komercialno, nima znane uporabe.
Nedavne študije
S pomočjo računskih simulacijskih tehnik v letu 2013 smo preučevali strukturne in energetske značilnosti, povezane s hidracijo HG (OH)2 V plinastim stanju.
Kovinsko-ligando koordinacijske energije in solvacijske energije smo izračunali in primerjali z spreminjanjem stopnje hidracije Hg (OH)2.
Med drugim je bilo ugotovljeno, da je očitno teoretično oksidacijsko stanje 1+ namesto domnevnih 2+, ki je običajno dodeljen za HG (OH)2.
Vam lahko služi: teoretična zmogljivostTveganja
Čeprav HG (OH)2 Kot taka ni bila izolirana v zadostni kvanti.
Lahko je strupen za živčni sistem, prebavni sistem, kožo, oči, dihalni sistem in ledvice.
Vdihavanje, zaužitje ali stik s kožo živosrebrnih spojin lahko povzročijo poškodbe, ki segajo od draženja oči in kože, nespečnosti, glavobolov, tresenja, poškodb črevesnega trakta, izgube spomina, do ledvične insuficience, med drugimi simptomi.
Živo srebro je bilo mednarodno prepoznano kot onesnaževalo. Večina živih spojin, ki pridejo v stik z okoljem.
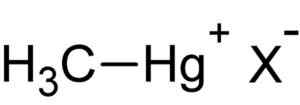 Metil živo srebro. Avtor: Naložil uporabnik: Rifleman 82. Vir: Neznano. Vir: Wikipedia Commons.
Metil živo srebro. Avtor: Naložil uporabnik: Rifleman 82. Vir: Neznano. Vir: Wikipedia Commons. Ta spojina je bioaccumula v živih organizmih, ki prehaja od tal do rastlin in od tam do živali. V vodnem okolju je prenos še hitrejši, v kratkem času prehaja iz zelo majhnih vrst do velikih.
Metil živo srebro ima strupen učinek za živa bitja in zlasti za človeka, kar ga zaužije skozi prehransko verigo.
Kadar je zaužitje s hrano še posebej škodljivo za majhne otroke in plodove pri nosečnicah, saj lahko nevrotoksin povzroči poškodbe možganov in živčni sistem pri tvorbi in rasti.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Wang, Xuefeng in Andrews, Lester (2005). Infrardeči spekter HG (OH)2 v trdnem neonu in argonu. Anorganska kemija, 2005, 44, 108-113. Okrevani iz lokalov.Acs.org.
- Amaro-Estrada, J.Yo., et al. (2013). Vodna solvacija Hg (OH)2: Energična in dinamična gostota Funkcionalna teoretična študija HG (OH)2-(H2Da)n (N = 1-24) strukture. J. Phys. Kem. Do 2013, 117, 9069-9075. Okrevani iz lokalov.Acs.org.
- Inoue, Yoshikazu in Munemori, Makoto. (1979). Soprecipitacija živega srebra (ii) z železom (iii) hidroksidom. Okoljska znanost in tehnologija. Zvezek 13, številka 4, april 1979. Okrevani iz lokalov.Acs.org.
- Chang, l.W., et al. (2010). Živčni sistem in vedenjska toksikologija. V razumevanju toksikologije. Okrevano od Scientirect.com.
- Haney, Alan in Lipsey, Richard L. (1973). Kopičenje in učinki hidroksida metil živega srebra v zemeljski prehranski verigi pod laboratorijskimi kondicijami. Okolje. Onesnaževanje. (5) (1973) pp. 305-316. Okrevano od Scientirect.com.
- « Značilnosti dinukleotida Flavin adenin (FAD), biosinteza
- Struktura 3-fosfata (G3P) gliceraldehida, funkcije »

