Struktura bakrenega hidroksida (II), lastnosti, nomenklatura, uporablja

- 4150
- 282
- Roman Schamberger
On bakreni hidroksid (ii) o CuPric hidroksid je zelenkasto modra ali modra kristalna anorganska trdna snov, katere kemijska formula je Cu (OH)2. Dobimo ga kot modro voluminozno oborino z dodajanjem alkalnega hidroksida v cupric raztopine (to pomeni, da vsebujejo ione Cu2+). Je nestabilna spojina.
Da bi povečali svojo stabilnost, ga pripravimo v prisotnosti amoniaka (NH3) ali fosfati.Če se pripravljate v prisotnosti amoniaka, obstaja material z dobro stabilnostjo in veliko velikostjo delcev.
 Vzorec cupric hidroksida, Cu (OH)2. Samzane na italijanski Wikipediji [javna domena] Vir: Wikipedia Commons
Vzorec cupric hidroksida, Cu (OH)2. Samzane na italijanski Wikipediji [javna domena] Vir: Wikipedia Commons Pri pripravi z bakrenim fosfatom (II), Cu3(Po4)2, Pridobimo lepšo velikost delcev in večjo površino. CuPric hidroksid se v kmetijstvu pogosto uporablja kot fungicid in baktericid ter za zdravljenje lesa, ki podaljša njegovo koristno življenje.
Uporablja se tudi kot živalska hrana. Uporablja se kot surovina za pridobivanje drugih bakrenih (ii) soli in v galvanoplastiki za pokrivanje površin.
Študije se izvajajo za oceno njihovega potenciala za boj proti bakterijskim in glivičnim okužbam pri človeku.
[TOC]
Struktura
Bakreni hidroksid (II) vsebuje neskončne bakrene ione (CU2+) Združena za hidroksilne skupine (OH-).
Verige so tako pakirane, da sta 2 kisikovega atoma iz drugih verig nad in pod vsakim atomom bakra, nato pa sprejmeta popačeno oktaedrsko konfiguracijo, ki je pogosta v večini bakrenih spojin (II).
V svoji strukturi so štirje atomi kisika na razdalji 1,93 a; Dva atoma kisika sta 2,63 A; In razdalja cu-cu je 2,95 do.
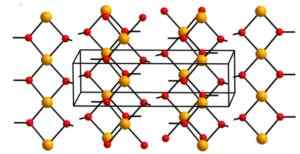 Kristalna struktura cupric hidroksida. Aleksandar kondinski [cc by-sa.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikipedia Commons
Kristalna struktura cupric hidroksida. Aleksandar kondinski [cc by-sa.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikipedia Commons Nomenklatura
- Bakreni hidroksid (ii).
- CuPric hidroksid.
- Baker dihidroksid.
Lastnosti
Fizično stanje
Kristalna trdna.
Molekularna teža
99,58 g/mol.
Tališče
Pred topi se pokvari. Degradacijska točka 229 ° C.
Vam lahko služi: 25 primerov topnosti v vsakdanjem življenjuGostota
3,37 g/cm3
Topnost
V vodi je skoraj netopna: 2,9 mikrogramov/l a 25 ° C. Hitro topno v kislinah, v koncentriranih alkalnih raztopinah in amonijevem hidroksidu. Netopna v organskih topilih. V vroči vodi razpade, ki ustvarja bakreni oksid (II), ki je bolj stabilen.
Druge lastnosti
Z lahkoto je topno v močnih kislinah in tudi v alkalnih koncentriranih raztopinah hidroksidov, da bi dali globoko modre anione, verjetno tip [Cun(OH)2N+2]2-.
Njegova stabilnost je odvisna od metode priprave.
Lahko ga razgradimo tako.
V prisotnosti presežka alkalije se razgradi nad 50 ° C.
Prijave
V kmetijstvu
Bakreni hidroksid (II) ima široko uporabo kot fungicid in antibakterijsko v kmetijskih pridelkih. Tu je nekaj primerov:
- Služi proti bakterijskim točkam ( Erwinia) V solati, ki se nanašajo kot foliarno zdravljenje.
- Proti bakterijskim mestom Xanthomonas pruni) V breskvah, za katere se uporablja latentno in foliarno zdravljenje.
- Uporablja se na listu in steblu borovnic z latentnimi aplikacijami.
- Proti gnilobi med shranjevanjem borovnic, ki jih povzroča Monilinia oxycocci, z latentno aplikacijo.
Za uporabo v kmetijstvu se uporablja bakreni hidroksid (II), ki ga pripravimo v prisotnosti fosfatov zaradi njegove majhne velikosti delcev.
 Gojenje solate. Vir: Pixabay
Gojenje solate. Vir: Pixabay V ohranitvi lesa
Les je zaradi organske narave občutljiv na napad žuželk in mikroorganizmov. Bakreni hidroksid (II) se uporablja kot biocid za glive, ki napadajo les.
Običajno se uporablja poleg kvartarne amonijeve spojine (NH4+). Bakreni hidroksid deluje kot fungicid, kvartarna amonijeva spojina pa deluje kot insekticid.
Na ta način se obdelani z lesom zdrži ali upira storitvenim pogojem in doseže potrebno stopnjo uspešnosti uporabnika. Vendar ima les, obdelan s temi spojinami, visoko raven bakra in je zelo jed za skupno jeklo, zato je potrebna vrsta nerjavečega jekla.
Vam lahko služi: reverzibilna reakcija: značilnosti in primeriKljub svoji uporabnosti se bakreni hidroksid (II) šteje za nekoliko nevaren biocid.
Zaradi tega obstaja zaskrbljenost, da se iz lesa obdela v okolje v količinah, ki so lahko škodljive za mikroorganizme, ki so seveda prisotni v vodah (reka, jezera, mokrišča in morje) ali tleh).
V Rayónovi proizvodnji
Od devetnajstega stoletja so za raztapljanje celuloze uporabljene amonialne raztopine bakrenega hidroksida (II). To je eden prvih korakov za pridobitev vlaken, imenovanih Rayón, s tehnologijo, ki jo je razvil Bemberg v Nemčiji.
Bakreni hidroksid (II) se raztopi v raztopini amoniaka (NH3), oblikovanje zapletene soli.
Kratko rafinirani bombažni vlakni se dodajo v raztopino amoniakalnega bakra, ki vsebuje bakreni hidroksid (II) v obliki oborine.
Bombažna celuloza tvori kompleks s tetra-amonijevim bakrenim hidroksidom v raztopini.
Nato je ta rešitev koagula med prehodom skozi ekstruzijsko napravo.
Zaradi visokih stroškov je to tehnologijo že premagala tehnologija Viscosa. Tehnologija Bemberga se trenutno uporablja samo na Japonskem.
V industriji živali
Uporablja se kot sledi v krmi za živali, saj je ena od snovi, ki jih zahtevajo kot mikrohranila za popolno prehrano živali.
 Koncentrirana hrana za govedo. Thamizhpparithi maari [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons
Koncentrirana hrana za govedo. Thamizhpparithi maari [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikipedia Commons To je zato, ker je pri višjih živih bitjih bistveni element, potreben za aktivnost različnih encimov, ki vsebujejo baker.
Na primer, med drugim je v encimu, ki sodeluje pri proizvodnji kolagena in encima, potrebnega za sintezo melanina.
Vam lahko služi: amineTo je spojina, ki je splošno priznana kot zavarovanje, če se dodajo ravni, ki so skladne z dobro prakso hrane.
 Mlečne krave. Vir: Pixabay
Mlečne krave. Vir: Pixabay V proizvodnji drugih bakrenih spojin (ii)
Predhodnik aktiven pri proizvodnji naslednjih bakrenih spojin (II): bakra (II), 2-oksanoata bakra (II) in bakrenih mil in bakrenih mil. V teh primerih se uporablja bakreni hidroksid (II), ki se sintetizira v prisotnosti amoniaka.
Druge uporabe
Uporablja se pri najlonski stabilizaciji, v baterijskih elektrodah; kot barvni fikser pri barvanju; kot pigment; pri insekticidih; pri zdravljenju s papirjem in obarvanju; pri katalizatorjih, kot katalizator pri vulkanizaciji polisulfidne gume; kot proti -snifni pigment; in v elektrolizi, v galvanoplastiki.
Prihodnje medicinske aplikacije
Bakreni hidroksid (II) je del bakrenih spojin, ki jih preučujemo v obliki nanodelcev za izločanje bakterij, kot je In. coli, K. Pneumoniae, str. Aeruginosa, Salmonella spp., Med drugim vzroki bolezni pri človeku.
Ugotovljeno je bilo tudi, da so bakreni nanodelci lahko učinkoviti Candida albicans, Gliva, ki je skupna vzrok za človeške patologije.
To kaže, da lahko nanotehnologija bakra igra pomembno vlogo proti bakterijam in glivam, ki povzročajo človeške okužbe, na teh področjih pa bi lahko bil zelo koristen bakreni hidroksid (II).
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Zvezek 7. Četrta izdaja. John Wiley & Sons.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek A7. VCH Verlagsgellschaft MBH.
- Ples, j.C.; Emeléus, h.J.; Sir Ronald Nyholm in Trotman-Deckenson,.F. (1973). Celovita anorganska kemija. Zvezek 3. Pergamon Press.
- Nacionalna knjižnica medicine. (2019). Baker (ii) hidroksid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Schiopu, n. in Tiruta-Brana, l. (2012). Lesni konzervansi. V toksičnosti materialov. Poglavje 6. Okrevano od Scientirect.com.
- Mordorski, b. in Friedman, do. (2017). Kovinski nanodelci za mikrobno okužbo. V funkcionaliziranih nanomaterialih za upravljanje mikrobne okužbe. Poglavje 4. Okrevano od Scientirect.com.
- Takashi Tsurumi. (1994). Raztopina vrtenje. V napredni tehnologiji predilnic. Poglavje 3. Okrevano od Scientirect.com.

