Lastnosti alifatskih ogljikovodikov, nomenklatura, reakcije, vrste

- 2923
- 104
- Cary Goyette
The Alifatski ogljikovodiki Vsi so tisti, ki nimajo aromatičnosti, ne v vohalnem smislu, ampak glede kemične stabilnosti. Klasifikacija ogljikovodikov na ta način je danes preveč dvoumna in nenatančna, saj ne diskriminira med različnimi vrstami ogljikovodikov, ki niso aromatični.
Tako imamo alifatske ogljikovodike in aromatične ogljikovodike. Slednje prepoznajo njihova osnovna enota: prstan Benncénico. Drugi lahko na drugi strani sprejmejo katero koli molekularno strukturo: linearno, razvejano, ciklično, nenasičeno, policiklično; Dokler nimajo konjugiranih sistemov, kot je benzen.
 Tekočino gorivo prižgane je sestavljeno iz mešanice alifatskih ogljikovodikov. Vir: Pixnio.
Tekočino gorivo prižgane je sestavljeno iz mešanice alifatskih ogljikovodikov. Vir: Pixnio. Izraz "alifatik" se je rodil iz grške besede "Aleiphar", kar pomeni maščobe, ki se uporablja tudi za olje. Zato je bila v devetnajstem stoletju ta klasifikacija dodeljena ogljikovodikom, pridobljenim iz mastnih izvlečkov; Medtem ko so aromatični ogljikovodiki ekstrahirali iz dreves in dišečih smol.
Vendar pa je bilo kot osnova za konsolidirano organsko kemijo ugotovljeno, da obstaja kemična lastnost, ki diferencirajo ogljikovodike, še pomembnejše od njihovih naravnih virov: aromatičnost (in ne dišave).
Na ta način so alifatski ogljikovodiki prenehali biti le tisti, pridobljeni iz maščob, da bi bili vsi tisti, ki jim primanjkuje aromatičnosti. Znotraj te družine imamo alkene in alkine, ne glede na to, ali so linearni ali ciklični. Zato se „alifatski“ šteje za netočno; Čeprav je koristno za reševanje nekaterih splošnih vidikov.
Na primer, ko se reče "skrajne" ali "verige" alifatske, molekularne regije aludirajo na to, kjer so aromatični obroči odsotni. Od vseh alifatskih ogljikovodikov je najpreprostejši po definiciji metan, cho4; Medtem ko je benzen najpreprostejši od aromatičnih ogljikovodikov.
[TOC]
Lastnosti alifatskih ogljikovodikov
Lastnosti alifatskih ogljikovodikov nihajo v različnih stopnjah, odvisno od tega. Obstajajo nizke in visoke molekularne mase, pa tudi linearne, razvejane, ciklične ali policiklične, tudi tiste iz neverjetnih tridimenzionalnih struktur; Kot pri Kubanu tudi v obliki kocke.
Vendar pa obstaja nekaj splošnosti, ki jih je mogoče omeniti. Večina alifatskih ogljikovodikov je hidrofobnih in apolarnih plinov ali tekočin, ki imajo nekaj bolj apolarnega kot druge, saj so na seznam vključeni tudi tisti, v katerih so ogljikove verige halogeni, kisik, dušik ali žveplo.
Vam lahko služi: boron: zgodovina, lastnosti, struktura, uporabeSo tudi vnetljive spojine, saj so dovzetne za oksidacijo v zraku pred minimalnim virom toplote. Ta lastnost postane bolj nevarna, če dodamo njegovo visoko nestanovitnost zaradi šibkih disperzijskih interakcij, ki ohranjajo kohezivne alifatske molekule.
Na primer, vidimo ga v butanu, plin, ki ga je mogoče utekočiniti z relativno lahkoto kot tudi s propanom. Oba sta zelo nestanovitna in vnetljiva, zato sta aktivni sestavni deli kuhinjskega plina ali žepnih svetilk.
Seveda se takšna nestanovitnost zmanjšuje, saj molekularna masa in ogljikovodik povzroča vse več viskoznih tekočin.
Nomenklatura
Nomenklatura ogljikovodikov se razlikuje celo več kot njegove lastnosti. Če gre za alko ali alkine, se sledijo enakim standardom, ki jih določa IUPAC: izberite najdaljšo verigo, pri čemer dodelite najnižje kazalnike najbolj nadomeščenemu koncu ali heteroatomi ali več reaktivnim skupinam.
Na ta način veste, kateri ogljik je vsak substituent, ali celo nenasičenost (dvojna ali trojna povezava). V primeru cikličnih ogljikovodikov je pred imenom substituenti, navedeni v abecednem vrstnem redu, sledila beseda „cikel“, štetje številk ogljika, ki ga integrirajo.
Na primer, razmislite o naslednjih dveh cikloheksanih:
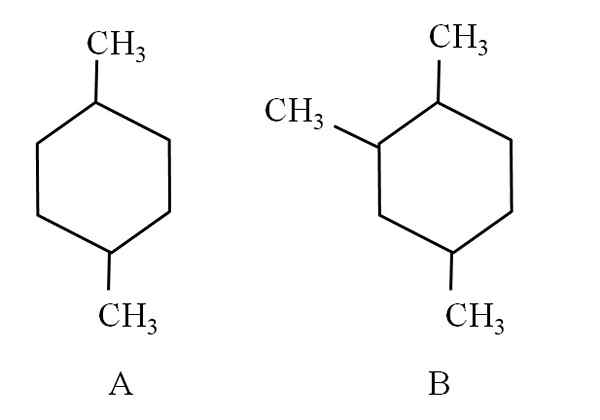 Dva cikloheksana, ki sta razvrščena kot alifatski ogljikovodiki. Vir: Gabriel Bolívar.
Dva cikloheksana, ki sta razvrščena kot alifatski ogljikovodiki. Vir: Gabriel Bolívar. Ciklohekan A se imenuje 1,4-dimetilcicloheksan. Če bi bil prstan pet ogljikov, bi bil 1,4-dimetilciclopentano. Medtem se ciklohekan B imenuje 1,2,4-trimetilcikloheksan in ne 1,4,6-cikloheksan, saj želi uporabiti najnižje kazalnike.
Zdaj lahko nomenklatura postane zelo zapletena za ogljikovodike operbotičnih struktur. Zanje obstajajo bolj specifična pravila, ki jih je treba razložiti ločeno in previdno; Tako kot pri ciljih terpeni, politikah in policikličnih spojinah.
Reakcije
Izgorevanje
Na srečo so reakcije manj raznolike za te ogljikovodike. Eden od njih je bil že omenjen: zlahka izgorevajo, kar proizvajajo ogljikov dioksid in vodo, poleg drugih oksidov ali plinov, odvisno od prisotnosti heteroatomov (CL, N, P, O, ETC.). Vendar pa Co2 in h2Ali so glavni izdelki izgorevanja.
Dodatek
Če imajo nenasičenost, lahko utrpijo dodajanje reakcij; to pomeni, da majhne molekule vključijo v svoje okostje kot substituente po določenem mehanizmu. Med temi molekulami imamo vodo, vodik in halogene (F2, Cl2, Br2 in jaz2).
Halogenacija
Po drugi strani pa alifatski ogljikovodiki pod pojavom ultravijoličnega sevanja (Hv) in toplota lahko prekine povezave C-H, da jih spremeni s povezavami C-X (C-F, C-CL itd.). To je reakcija halogenacije, ki jo opazimo v zelo kratkih verigah alkanov, kot sta metan ali pentan.
Vam lahko služi: nitrite: lastnosti, struktura, nomenklatura, tvorbaCraqueo
Druga reakcija, ki jo lahko trpijo alifatski ogljikovodiki, zlasti z dolgimi verigami, je toplotno pokanje. Sestavljen je iz oskrbe z intenzivno toploto, tako da toplotna energija razbije C-C vezi in s tem nastajajo majhne molekule, bolj navajane na trgu goriva, iz velikih molekul.
Štiri zgornje reakcije so glavne, ki lahko trpijo alifatski ogljikovodik, pri čemer je zgorevanje najpomembnejše od vseh, saj ne diskriminira nobene spojine; Vsi bodo goreli v prisotnosti kisika, vendar vsi ne bodo dodali molekul ali vdreli v majhne molekule.
Fantje
Ne neskončne spojine alifatske ogljikovodike, ki so posledično razvrščene bolj specifične, kar kaže na stopnjo njihove nenasičenosti, pa tudi vrsto strukture, ki jo imajo.
Glede na to, kako nenasičeni so, imamo alkane (nasičene), alkene in alkine (nenasičene).
Za alkane je značilno, da imajo preproste povezave C-C, v alkenih in alkinih. Zelo splošen način za njihovo vizualizacijo je razmišljati o ogljikovih okostjih alkanov kot cikzagenih in zložljivih verig, ki so "kvadratne" za alkene in "ravne črte" za alkine.
To je zato, ker imajo dvojne in trojne vezi v svojih rotacijah energijo in stenrično omejitev, "utrjevanje" njihovih struktur.
Alkitos in alkine so lahko razvejani, ciklični ali policiklični. Zato cikloalkanos, cikloalkinos, cikloalkinos in spojine, kot so dekalin (kolesarska struktura), adamantano (podobno kot baseball pokrov), heptalen, gonano, med drugim upoštevamo tudi alifatske ogljikovode.
Iz alkenov nastanejo druge vrste ogljikovodikov, kot so cilji (z dvema dvojnima vezama), polienozni (z mnogimi dvojnimi nadomestnimi vezmi) in terpeni (spojine, pridobljene iz izoprena, diena).
Prijave
Ponovno se lahko uporaba teh ogljikovodikov razlikuje glede na to, od tega se upošteva. Vendar je bilo v odsekih lastnosti in reakcij jasno, da vse zgorevanje, ne le za sproščanje molekul plina, temveč tudi svetlobo in toploto. Tako so rezervoarji za energijo, ki so koristni za gorivo ali toplotni viri.
Zato se uporabljajo kot del sestave bencina, za zemeljski plin, v Bunsenovih svetilkah in na splošno, da lahko izvirajo.
Vam lahko služi: pravilo oktetaEden najbolj izjemnih primerov je acetilen, HC≡CH, katerega zgorevanje omogoča vzbujanje kovinskih ionov vzorca v atomski absorpcijski spektrometriji, ki se izvaja na analitičnih testih. Prav tako se lahko nastali požar uporablja za zvarke.
Tekoči alifatski ogljikovodiki, kot so parafiniki, se pogosto uporabljajo kot topila za ekstrakcijo maščob. Poleg tega lahko njegovo delovanje topila uporabite za odstranjevanje lis, sklenov, slik ali preprosto za pripravo rešitev določene organske spojine.
Največja molekularna masa, ki je že viskozna ali trdna, je namenjena izdelavi smol, polimerov ali zdravil.
Glede na izraz "alifatik" se običajno uporablja za navajanje teh regij v makromolekuli, ki nimajo aromatičnosti. Na primer, asfalteni so površinsko opisani kot aromatično jedro z alifatskimi verigami.
Primeri
Sprva je bilo rečeno, da je metan najpreprostejši od alifatskih ogljikovodikov. Sledi jim propan, cho3Pogl2Pogl3, Butano, pogl3Pogl2Pogl2Pogl3, Pentano, pogl3Pogl2Pogl2Pogl2Pogl3, Octane, Nonano, Dean in tako naprej, ki imajo vse daljše alkane.
Enako velja za etilen, Cho2= Pogl2, Propeno, pogl3Ch = ch2, Buteno, pogl3Pogl2Ch = ch3, In za ostale alkine. Če obstajata dve dvojni vezi, sta oley, in če sta več kot dve, polienas. Prav tako lahko v istem okostju obstajajo dvojne in trojne povezave, kar povečuje strukturno zapletenost.
Med cikloalkanosi lahko omenimo ciklopropan, ciklobutana, ciklopentano, cikloheksan, cikloheptano, ciklooktan, pa tudi cikloheksen in cikloheksin. Iz vseh teh ogljikovodikov dobimo razvejane derivate, ki še dodatno pomnožijo razpoložljive primere (na primer 1,4-dimetilcicloheksano).
Od najbolj reprezentativnih terpenov imamo limonen, mentol, pinene, vitamin A, Escualeno itd. Polietilen je nasičen polimer z enotami -CH2-Pogl2-, Torej je tudi primer teh ogljikovodikov. Drugi primeri so že navedeni v prejšnjih razdelkih.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Čelada, Anne Marie, ph.D. (22. avgust 2019). Opredelitev alifatske ogljikovodike. Okreval od: Thoughtco.com
- Wikipedija. (2019). Alifatska spojina. Pridobljeno iz: v.Wikipedija.org
- Kemija librettexts. (20. avgust 2019). Alifatski ogljikovodiki. Okrevano od: kem.Librettexts.org
- Elizabeth Wyman. (2019). Alifatski ogljikovodiki: definicija in lastnosti. Študij. Okrevano od: študij.com
- « Socialna razsežnost je človek, izobraževanje, znanje, pravica, zdravje
- 100 radovednih podatkov o živalih »

