Koncept hibridizacije ogljika, vrste in njihove značilnosti
- 1649
- 321
- Miguel Gutmann DVM
The Hibridizacija ogljika Pomeni kombinacijo dveh čistih atomskih orbitalov, da tvori novo "hibridno" molekularno orbitalo z lastnimi lastnostmi. Pojem atomskega orbitala daje boljšo razlago kot prejšnji koncept orbite, da vzpostavi približek, kje je več verjetno, da bo v atomu našel elektron.
Z drugimi besedami, atomska orbitala je reprezentacija kvantne mehanike, ki daje predstavo o položaju elektrona ali para elektronov na določenem območju znotraj atoma, kjer je vsaka orbitala določena glede na vrednosti njegovih številke kvantno.

Kvantne številke opisujejo status sistema (na primer elektron v atomu) v določenem času z energijo, ki pripada elektronu (n), kotni momentum, ki opisuje v svojem gibanju (L), povezan magnetni moment (m) in elektron se med premikanjem v atomu (-e) obrne.
Ti parametri so edinstveni za vsak elektron v orbitalu, tako da dva elektrona ne moreta imeti popolnoma enakih vrednosti štirih kvantnih števil in vsakega orbitala lahko zasedeta dva elektrona pri večini elektronov.
[TOC]
Kaj je hibridizacija ogljika?
Za opis hibridizacije ogljika je treba upoštevati, da so značilnosti vsake orbitale (njene oblike, energije, velikosti itd.) odvisno od elektronske konfiguracije, ki jo ima vsak atom.
To pomeni, da so značilnosti vsake orbitalne odvisne od razpolaganja elektronov v vsaki "plasti" ali ravni: od najbližjega jedra do najbolj oddaljenega, znanega tudi kot valencia plast.
Vam lahko služi: natrij: zgodovina, struktura, lastnosti, tveganja in uporabeNajbolj zunanji elektroni so edini, ki so na voljo za povezavo. Ko se med dvema atoma nastaja kemična vez, nastane prekrivanje ali prekrivanje dveh orbitalov (po enega od vsakega atoma) in je to tesno povezano z geometrijo molekul.
Kot je navedeno zgoraj, lahko vsako orbitalo napolnite z največ dveh elektronov, vendar mora načelo Aufbau vzorčiti spodaj:

Na ta način je zapolnjena prva stopnja 1s, Nato 2s, sledi 2str In tako naprej, odvisno od tega, koliko elektronov ima atom ali ion.
Tako je hibridizacija pojav, ki ustreza molekulam, saj lahko vsak atom prispeva le čiste atomske orbitale (s, str, d, F) in zaradi kombinacije dveh ali več atomskih orbital se oblikuje enaka količina hibridnih orbitalov, ki omogočajo povezave med elementi.
Vrste hibridizacije
Atomske orbitale imajo različne oblike in prostorske usmeritve, ki se povečujejo v zapletenosti, kot je prikazano spodaj:
Opazimo, da obstaja samo ena vrsta orbitala s (sferična oblika), tri vrste orbitala str (Lobularna oblika, kjer je vsak reženj usmerjen na vesoljsko osi), pet vrst orbitala d in sedem vrst orbitala F, kjer ima vsaka vrsta orbitala popolnoma enako energijo kot energija svojega razreda.
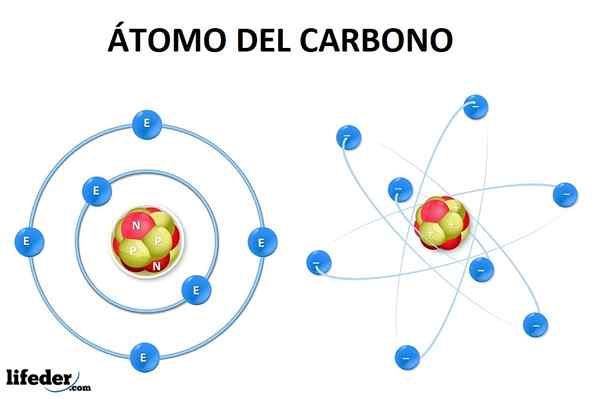
Atom ogljika v svojem temeljnem stanju ima šest elektronov, katerih konfiguracija je 1s22s22str2. To pomeni, da bi morali zasesti 1. stopnjos (dva elektrona), 2s (Dva elektrona) in delno 2P (preostala dva elektrona) po načelu Aufbau.
Vam lahko služi: alotropijaTo pomeni, da ima ogljikov atom le dva manjkajoča elektrona v orbitali 2str, Vendar ni mogoče razložiti tvorbe ali geometrije molekule metana (ch4) ali drugo bolj zapleteno.
Za oblikovanje teh povezav je potrebna hibridizacija orbitalov s in str (V primeru ogljika) za ustvarjanje novih hibridnih orbitalov, ki celo razložijo dvojne in trojne vezi, kjer elektroni pridobijo najbolj stabilno konfiguracijo za tvorbo molekul.
Sp3
Hibridizacija sp3 Sestavljen je iz tvorbe štirih "hibridnih" orbitalov iz orbital 2s, 2px, 2 pin in 2pz Čisto.
Tako je na ravni 2, kjer so na voljo štirje elektroni, na voljo za nastajanje štirih vezi in so vzporedno naročeni, da imajo manj energije (večja stabilnost).
Primer je molekula etilen (c2H4), katerih povezave tvorijo 120 ° kote med atomi in zagotavljajo ravno trigonalno geometrijo.
V tem primeru se ustvarijo preproste povezave C-H in C-C (zaradi orbital sp2) in dvojna C-C vez (zaradi orbitala str), Da tvori najbolj stabilno molekulo.

Sp2
S hibridizacijo SP2 Tri "hibridne" orbitale nastajajo iz čiste 2S orbitale. Poleg tega dobimo čisti P orbital, ki sodeluje pri tvorbi dvojne vezi (imenovane pi: "π").
Primer je molekula etilen (c2H4), katerih povezave tvorijo 120 ° kote med atomi in zagotavljajo ravno trigonalno geometrijo. V tem primeru se ustvarijo preproste povezave C-H in C-C (zaradi SP orbital2) in dvojna C-C vez (zaradi orbitalne p), ki tvori najbolj stabilno molekulo.
Lahko vam služi: Kemične reakcije: značilnosti, deli, vrste, primeri Sp
Sp
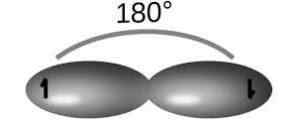
S pomočjo hibridizacije SP sta iz čiste 2S orbitalne orbitalne orbitale vzpostavljeni dve "hibridni" orbitali. Na ta način tvorijo dve čisti orbitali, ki sodelujeta pri oblikovanju trojne povezave.
Za to vrsto hibridizacije molekula acetilen (c2H2), katerih povezave tvorijo 180 ° kote med atomi in zagotavljajo linearno geometrijo.
Za to strukturo obstajajo preproste povezave C-H in C-C (zaradi Orbitals SP) in trojne C-C povezave (to je dve PI vezi zaradi orbital P), da dobimo konfiguracijo z manj elektronske odbojnosti.

Reference
- Orbitalna hibridizacija. Pridobljeno iz.Wikipedija.org
- Lisica, m. Do., In Whitsell, J. K. (2004). Organska kemija. Okrevano iz knjig.Google.co.pojdi
- Carey, f. Do., in Sundberg, r. J. (2000). Napredna organska kemija: Del A: Struktura in mehanizmi. Okrevano iz knjig.Google.co.pojdi
- Anslyn, e. V., In Dougherty, D. Do. (2006). Sodobna fizična organska kemija. Okrevano iz knjig.Google.co.pojdi
- Mathur, r. B.; Singh, b. Str., In Panda, s. (2016). Ogljikovi nanomateriali: sinteza, struktura, lastnosti in aplikacije. Okrevano iz knjig.Google.co.pojdi
- « Karakteristike kemične poroznosti, vrste in primeri
- Značilnosti morfosintaktične ravni in literarni viri (primeri) »

