Značilnosti karbonilne skupine, lastnosti, nomenklatura, reaktivnost
- 4966
- 677
- Miguel Gutmann DVM
On Karbonilna skupina Gre za organsko in oksigenirano funkcionalno skupino, ki spominja na molekulo plina ogljikovega monoksida. Predstavljen je kot C = O, in čeprav se šteje za organsko, ga lahko najdemo tudi v anorganskih spojinah; Kot ogljikova kislina, h2Co3, ali v organometalnih spojinah s CO kot vezavo.
Vendar je to v kemiji ogljika, življenju, biokemiji in drugih analognih znanstvenih vejah, kjer ta skupina izstopa za svoj izjemen pomen. Če ne bi bilo zanj, veliko molekul ni moglo komunicirati z vodo; Beljakovine, sladkorji, aminokisline, maščobe, nukleinske kisline in druge biomolekule ne bi bilo, če ne bi bilo zanj.
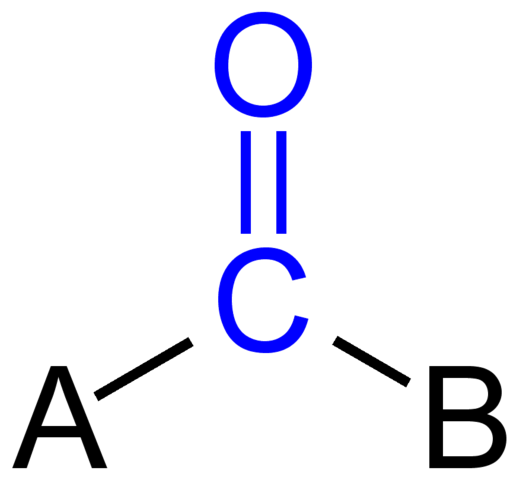
 Karbonilna skupina. Vir: Jü [javna domena]
Karbonilna skupina. Vir: Jü [javna domena] Zgornja slika prikazuje, kako ta skupina izgleda v splošnem okostju spojine. Upoštevajte, da je poudarjena z barvno modro, in če bi odstranili nadomestke A in B (R ali R ', enako veljavni), bi obstajala molekula ogljikovega monoksida. Prisotnost teh substituentov določa veliko število organskih molekul.
Če sta A in B atoma ogljika, kot so kovine ali nemetalni elementi, lahko naredite organometalne ali anorganske spojine. V primeru organske kemije bosta substituenta A in B vedno ali vodikova atoma, gazirane linije, z ali brez posledic, cikličnih ali aromatičnih obročev.
Tako začne razumeti, zakaj je karbonilna skupina precej pogosta za tiste, ki preučujejo naravne ali zdravstvene vede; Povsod je in brez tega se molekularni mehanizmi, ki se zgodijo v naših celicah.
Če bi lahko povzeli njen pomen, bi rekli, da zagotavlja polarnost, kislost in reaktivnost na molekulo. Kjer obstaja karbonilna skupina, je več kot verjetno, da lahko samo na tem mestu molekula trpi za preobrazbo. Zato je strateško mesto za razvoj organske sinteze z oksidacijami ali nukleofilnimi napadi.
[TOC]
Značilnosti in lastnosti karbonilne skupine
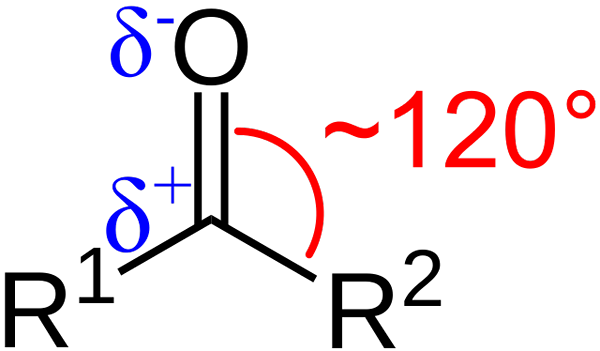 Strukturne značilnosti karbonilne skupine. Vir: Azaline Gomberg [javna domena].
Strukturne značilnosti karbonilne skupine. Vir: Azaline Gomberg [javna domena]. Kakšne so strukturne in elektronske značilnosti karbonilne skupine? Gor1 in r2 Namesto A in B, ki obstaja med substituenti in atomom kisika kot kot 120 ° C; To pomeni, da je geometrija okoli te skupine trigonalna.
Kaj je taka geometrija2; Tako bo imel ogljik tri orbitale SP2 Za oblikovanje preprostih kovalentnih povezav z r1 in r2, in orbital str čisto vzpostaviti dvojno vez s kisikom.
Na ta način je razloženo, kako lahko obstaja dvojna vez c = o.
Če je slika opažena, bo tudi razvidno, da ima kisik večjo elektronsko gostoto, δ-, kot ogljik, δ+. To je zato, ker je kisik bolj elektronegativen kot ogljik, zato "krade" elektronsko gostoto; In ne samo njemu, ampak tudi za substituente r1 in r2.
Posledično nastane trajni dipolni trenutek, ki je lahko večje ali manjše, odvisno od molekularne strukture. Kjer je karbonilna skupina, bodo dipolni trenutki.
Resonančne strukture
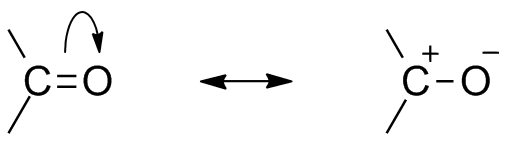 Dve resonančni strukturi za to organsko skupino. Vir: mfomich [CC0]
Dve resonančni strukturi za to organsko skupino. Vir: mfomich [CC0] Druga posledica elektronegativnosti kisika je, da v karbonilni skupini obstajajo resonančne strukture, ki definirajo hibrid (kombinacija obeh struktur nadrejene slike). Upoštevajte, da se lahko par elektronov preseli v orbital str kisika, ki pušča ogljikov atom s pozitivno delno obremenitvijo; Karbokacija.
Vam lahko služi: cikloalcanos: lastnosti, reakcije, uporabe, primeriObe strukturi se zgodita nenehno, zato ogljik ohranja stalno pomanjkanje elektronov; to pomeni, da bodo za katione, ki so zelo blizu, doživeli elektrostatično odbojnost. Če pa gre za anion ali vrsta, ki lahko darova elektrone, bo za ta ogljik čutila močno privlačnost.
Potem se zgodi tisto, kar je znano kot nukleofilni napad, kar bo razloženo v naslednjem razdelku.
Nomenklatura
Ko ima spojina skupino c = o, se reče, da je karbonil. Tako ima, odvisno od narave karbonilne spojine.
Čeprav, ne glede na to, kaj je, imajo vsi skupno pravilo: C = O ima v času kotiranja ogljikovih atomov prednostno nalogo v gazirani verigi.
To pomeni, da če obstajajo posledice, halogenski atomi, dušikove funkcionalne skupine, dvojne ali trojne povezave, nobena od njih ne more imeti manjšega števila kot c = o; Zato se najdaljša veriga začne navajati čim bližje karbonilni skupini.
Če je nasprotno, je več c = ali v verigi in eden od njih je del funkcionalne skupine večje hierarhije, potem bo karbonilna skupina nosila večji lokator in bo omenjena kot substituent OXO.
In kaj se reče hierarhija? Naslednje, od najvišjega do manjšega:
-Karboksilne kisline, rcooh
-Ester, rcoor '
-Amida, rconh2
-Aldehide, rHoc (ali rcho)
-Cetona, RCOR
Zamenjava R in R 'z molekularnimi segmenti, neskončnimi karbonilnimi spojinami, ki jih predstavljajo družine zgoraj: karboksilne kisline, estri, amidas itd. Vsak je povezal svojo tradicionalno nomenklaturo ali IUPAC.
Reaktivnost
Nukleofilni napad
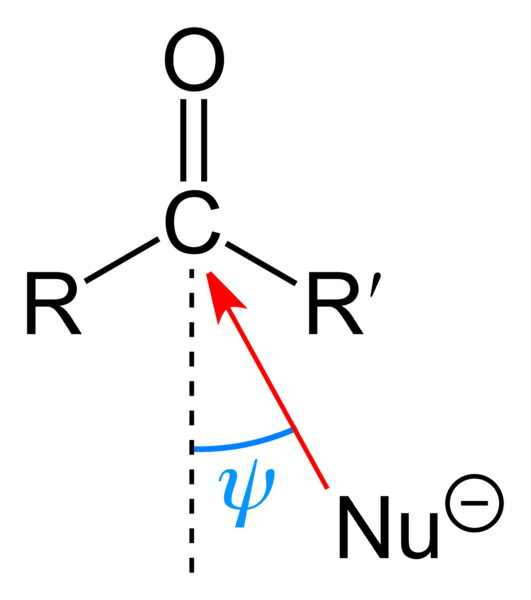 Nukleofilni napad na karbonilno skupino. Vir: Benjah-BMM27 [javna domena]
Nukleofilni napad na karbonilno skupino. Vir: Benjah-BMM27 [javna domena] Zgornja slika prikazuje nukleofilni napad, ki ga je utrpela karbonilna skupina. Nukleofil, NU-, Lahko je anion ali nevtralna vrsta z razpoložljivimi elektroni; Kot amonijak, NH3, Na primer. To izgleda izključno na ogljiku, ker po resonančnih strukturah predstavlja pozitivno delno obremenitev.
Pozitivna obremenitev privlači NU-, ki se bodo želeli približati "boku", tako da je substituenta R in R najmanjša sterična ovira. Odvisno od tega, kako zajetni so, ali velikosti istega Nu-, Napad se bo zgodil na različne kote ψ; Lahko je zelo odprta ali zaprta.
Ko se napad zgodi, bo oblikovana vmesna spojina, nu-cr'-o-; to pomeni, da kisik ostane z nekaj elektroni, ki omogočajo NU- v karbonilno skupino.
Ta negativno obremenjeni kisik lahko posreduje v drugih korakih reakcije; Proton kot hidroksilna skupina, OH ali sprošča kot molekula vode.
Vam lahko služi: koeficient particije: distribucija, distribucija, aplikacijeVključeni mehanizmi in produkti reakcije, pridobljene s tem napadom, so zelo raznoliki.
Odvod
Nujno sredstvo NU- Lahko je veliko vrst. Za vsakega specifičnega za reakcijo s karbonilno skupino, različni derivati.
Na primer, kadar je omenjeno nukleofilno sredstvo amin, NH2A, iminas izvira, r2C = nr; Če je hidroksilamin, NH2Oh, rezultati v oksimi, rr'c = noh; Če je to cianidni anion, CN-, Cianohidrinas, rr'c (OH) CN in s tem z drugimi vrstami.
Zmanjšanje
Sprva je bilo rečeno, da je ta skupina oksigenirana in zato zarjavela. To pomeni, da lahko glede na pogoje povezave zmanjšate ali izgubijo kisik, ki ga nadomešča z vodiki. Na primer:
C = o => ch2
Ta transformacija kaže, da je bila karbonilna skupina zmanjšana na metilen skupino; Zaradi izgube kisika je prišlo do povečanja vodika. V ustreznejših kemičnih izrazih: karbonilna spojina se zmanjša na alkan.
Če gre za cetono, rcor ', v prisotnosti Hydraracina, h2N-NH2, in močno osnovno okolje se lahko zmanjša na svoj alkan; Ta reakcija je znana kot Wolff-Kishner znižanje:
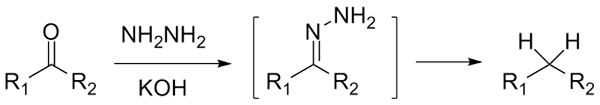 Zmanjšanje Wolff-Kishner. Vir: Jü [CC0]
Zmanjšanje Wolff-Kishner. Vir: Jü [CC0] Če je na drugi strani reakcijska mešanica sestavljena iz amalgamata cinka in klorovodikove kisline, je reakcija znana kot Clemmensen Redction:
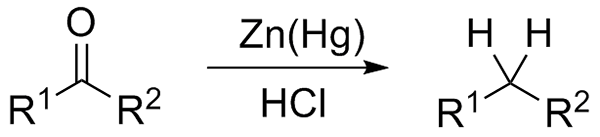 Zmanjšanje Clemmensen. Vir: Wikimedia Commons.
Zmanjšanje Clemmensen. Vir: Wikimedia Commons.
Trening acetalnega in cealnega treninga
Karbonilna skupina ne more samo dodati nukleofilnih sredstev NU-, Toda v kislinskih pogojih lahko reagira tudi z alkoholi s podobnimi mehanizmi.
Ko aldehid ali cetona delno reagirajo z alkoholom, izvirajo hemiacetali ali hemicetali. Če se reakcija izvede v celoti, so izdelki acetali in ketali. Naslednje kemijske enačbe povzamejo in razjasnijo novo omenjene:
Rcho + r3Oh g rchoh (oz3) (Hemiacetal) + r4Oh g rch (oz3) (Ali4) (Acetal)
RCOR2 + R3Oh g rcor2(OH) (ali3) (Hemično) + r4Oh g rcor2(Ali3) (Ali4) (ketal)
Prva reakcija ustreza tvorbi hemiacetal in acetal iz aldehida, drugi hemitali in ketali pa iz ketona.
Te enačbe niso dovolj preproste, da bi razložile nastanek teh spojin; Vendar je za prvi pristop k temi dovolj, da se dodajo, da se dodajo alkoholi in da njihove stranske verige r (r (r R (r3 in r4) Povezani so s karbonilnim ogljikom. Zato ali oz3 in ali ali4 Do začetne molekule.
Glavna razlika med acetalnim in ketalom je prisotnost vodikovega atoma, povezanega z ogljikom. Upoštevajte, da ketonu primanjkuje tega vodika.
Fantje
Zelo podobno, kot je razloženo v razdelku za nomenklaturo za karbonilno skupino, njegove vrste temeljijo na tem, kaj so substituenti A in B, ali R in R '. Zato obstajajo strukturne značilnosti, ki imajo vrsto karbonilnih spojin, ki presegajo samo vrstni red ali vrsto povezav.
Na primer, omenili smo načelo analogije med to skupino in ogljikovim monoksidom, C≡O. Če je molekula brez vodikovih atomov in če obstajata tudi dva terminala C = O, bo to ogljikov oksid, CnTudi2. Za n enakovredno 3, boste imeli:
Vam lahko služi: isóbarosO = c = c = c = o
Kar je, kot da sta bili dve molekuli C≡O povezani in ločeni z ogljikom.
Karbonilne spojine ne morejo izpeljati samo iz CO plina, ampak tudi iz ogljikove kisline, H2Co3 ali oh- (c = o) -oh. Tukaj sta dva OH R in R 'in nadomeščanje katerega od njih ali njihovih vodikov dobimo derivati ogljikove kisline.
In potem so tu derivati karboksilne kisline, RCOOH, pridobljeni s spreminjanjem R identitet ali zamenjavo h z drugim atomom ali verigo R '(ki bi povzročil ester, rcoor').
Kako ga prepoznati v aldehidosu in ketonih
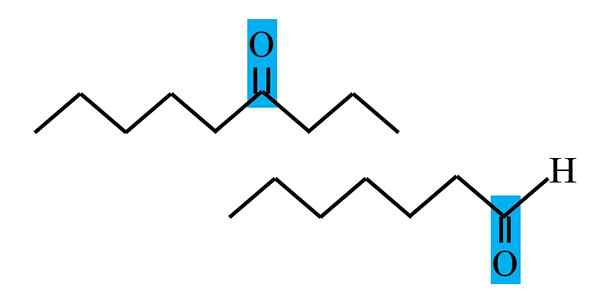 Diferenciacija ketona in aldehida iz strukturne formule. Vir: Gabriel Bolívar.
Diferenciacija ketona in aldehida iz strukturne formule. Vir: Gabriel Bolívar. Tako aldehido kot ketoni imajo skupno prisotnost karbonilne skupine. Njegove kemijske in fizikalne lastnosti so posledica tega. Vendar njihova molekularna okolja v obeh spojinah ni enaka; V prvem je v terminalnem položaju in v sekundah, kjer koli v verigi.
Na primer, na zgornji sliki je karbonilna skupina znotraj modrikastega polja. V ketonih, poleg tega polja, mora obstajati še en segment ogljika ali verige (na glavo); Medtem ko je v aldehidih, lahko obstaja samo vodikov atom (spodaj).
Če je C = O na enem koncu verige, bo to aldehid; To je najbolj neposreden način, da ga ločimo od cetone.
Id
Toda kako eksperimentalno vedeti, če je neznana spojina aldehid ali keton? Obstajajo številne metode, iz spektroskopske (infrardeče absorpcije sevanja, IR) ali organskih kvalitativnih testov.
Kar zadeva kvalitativne eseje, temeljijo na reakcijah, ki jih bo analitik ob pozitivnem opazoval fizični odziv; Sprememba barve, sproščanje toplote, tvorba mehurčkov itd.
Na primer dodajanje vzorcu kislina raztopina K2Cr2Tudi7 Aldehid se bo spremenil v karboksilno kislino, zaradi česar se barva raztopine spremeni iz oranžne v zeleno (pozitiven test). Medtem ketoni ne reagirajo, zato analitik ne opazi nobene spremembe barve (negativni test).
Drugo preskušanje je uporaba reagenta Tollens, [AG (NH3)2]+, tako da aldehid zmanjšuje katione AG+ do kovinskega srebra. In rezultat: tvorba srebrnega ogledala na dnu epruvete, kjer je bil vzorec nameščen.
Glavni primeri
Končno bo navedena vrsta primerov karbonilnih spojin:
-Pogl3COOH, ocetna kislina
-Hcooh, mravljična kislina
-Pogl3Coch3, Propanona
-Pogl3Coch2Pogl3, 2-butanon
-C6H5Coch3, acetofenon
-Pogl3Cho, etanal
-Pogl3Pogl2Pogl2Pogl2Cho, Pentanal
-C6H5Cho, benzaldehid
-Pogl3Conh2, acetamid
-Pogl3Pogl2Pogl2Cooch3, Propil acetat
Zdaj, če se navajajo primeri spojin, ki preprosto posedujejo to skupino, bi bil seznam skoraj neskončen.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Reid Danielle. (2019). Karbonila skupina: lastnosti in pregled. Študij. Okrevano od: študij.com
- Sharleen Agvateesiri. (5. junij 2019). Karbonilna skupina. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Wiki Kids Ltd. (2018). Karbonilne spojine. Okrevano od: preprosto.Znanost
- Toppr. (s.F.). Nomenklatura in struktura karbonilne skupine. Okrevano od: toppr.com
- Clark J. (2015). Oksidacija aldehidov in ketonov. Okrevano od: Chemguide.co.Združeno kraljestvo

