Carbon 12 jedrski zapis, zgodovina, komentarji
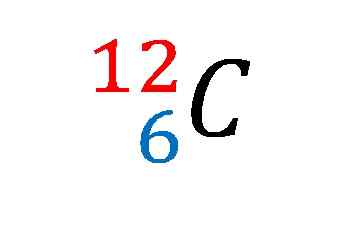
- 4827
- 160
- Dexter Koch
On Ogljik-12 Je najpogostejši izotop ogljikovega elementa z 98,93% številčnosti. Poleg tega je glavna odgovorna za vse lastnosti in aplikacije, pripisane ogljikovemu elementu.
On 12C Z atomsko maso natanko 12 Daltona služi kot referenca za vzpostavitev atomskih mas preostalih nukleidov. Atom 12C je sestavljen iz šestih protonov, nevtronov in elektronov; Vendar se masa elektronov šteje za zanemarljivo.
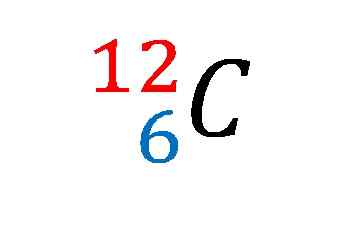 Jedrska zapis za ogljikov izotop-12. Vir: Gabriel Bolívar
Jedrska zapis za ogljikov izotop-12. Vir: Gabriel Bolívar Elementi imajo običajno atomske mase, izražene kot celotna številka, sledijo decimali, ker imajo elementi več stabilnih izotopov.
Zato so atomske mase elementov izražene kot tehtano povprečje atomskih mas njihovih različnih izotopov. Ob upoštevanju tega 12C ima obilje 98,93%in 13C Obilje 1,15%, atomska masa ogljika je 12.011 Daltona.
Atomska masa elementa je izražena kot povprečje atomskih mas njegovih različnih atomov glede na dvanajsti del mase 12C, znana kot enotna enota atomske mase; prej skrajšana kot "Uma", trenutno pa kot "u".
[TOC]
Jedrska zapis
Na zgornji sliki je bil prikazan jedrski zapis ali simbol za izotop ogljika-12.
Opisovanje je isto kot sedenje značilnosti odličnosti ogljikovega atoma. Njegova atomska številka 6 označuje število protonov v njenem jedru. Številka 12 je enaka vsoti protonov in nevtronov, zato gre za atomsko maso; ki je sorazmerna z jedrsko maso.
Vam lahko služi: železov oksidIn čeprav ta zapis ne kaže, obstaja 6 elektronov, ki preprečujejo pozitivno obremenitev protonov v jedru. Z vidika kemičnih vezi so štirje od teh šestih elektronov tisti, ki vzpostavljajo temelje življenja, kot ga poznamo.
Zgodovina
Daltonove preiskave (1810) so poudarile, da voda vsebuje odstotek kisika 87,7% in 12,5% vodika. Toda, Dalton je rekel, da je vodna formula OH. Davy in Berzelius (1812) sta vodno formulo popravila na H2Tudi.
Nato je Berzelius našel sestavo naslednje vode: kisik 88,8% in vodik 11,2%. Menil je, da je atomska teža vodika 1 g, kisik pa 16 g.
Nato so spoznali, da bi z uporabo atomske mase 1 g za vodik atomska teža kisika znašala 15,9 g. Ta razlog je med drugim privedel do vzpostavitve atomske mase 16 g kisika kot referenčnega standarda za atomske mase različnih kemičnih elementov.
Kisik je bil uporabljen kot referenčni vzorec od konca 19. stoletja do 1961, ko je bilo odločeno, da bo ogljik uporabil kot referenčni standard za vzpostavitev atomskih mas različnih elementov.
Pred letom 1959 sta IUPAP in IUPAC uporabila element kisika, da sta mol določila na naslednji način: 1 mol je število atomov kisika v 16 g.
Splošni komentarji
Govoriti o 12C naj bi se skliceval na ogljik kot celoto; ali vsaj 98% svojega bistva, kar je dovolj za tak približek. Zato ta izotop nima uporabe sam po sebi, medtem ko element kot takega, in trdne snovi, ki vključujejo na stotine aplikacij.
Vam lahko služi: cenjene rešitveVendar je treba opozoriti, da imajo živi organizmi posebno prednost pred tem izotopom 13C; to je odstotek 13C ali odnos 12C/13C se razlikuje glede na ekosisteme, regije ali živalske vrste.
To je lahko posledica dejstva, da molekule s preveč atomi 13C, težji, ovirajo ali škodijo presnovnim procesom in delovanje telesnih celic; tudi če odstotek 13C Pri živih bitjih je bilo malo višje od 1%.
Zato 12C je izotop ogljika, odgovoren za življenje. In 14C "Časovni meter" njegovih ostankov, zahvaljujoč radioaktivnemu razpadu.
Še ena posredna uporabnost 12C je ustvariti "kontrast" za tehniko jedrske magnetne resonančne spektroskopije 13C, s katero je mogoče razjasniti gazirano strukturo organskih spojin (odkrivanje in gradnjo).
Reference
- Phillips, bazilika. (8. julij 2019). Kaj je skupni izotop ogljika? Znanstvenik.com. Okrevano od: Znanstvenik.com
- César Tomé López. (2019). Atomskih uteži. Pridobljeno iz: Culturacienta.com
- Elsevier. (2019). Ogljik-12. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- R. ladja. (s.F.). Jedrska zapis. Okrevano od: hiperfizika.PHY-ASST.GSU.Edu
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- « Značilnosti karbonilne skupine, lastnosti, nomenklatura, reaktivnost
- Heriberto Frías Biografija, slog, deluje »

