Zgodovina fosforja, lastnosti, strukture, pridobivanje, uporabe

- 3462
- 788
- Stuart Armstrong
On ujemanje Gre za nemetalni element, ki ga predstavlja kemični simbol P in ima atomsko številko 15. Predstavlja tri glavne alotropne oblike: beli, rdeči in črni fosfor. Beli fosfor je fosforescenten, zgorele spontano, ko je izpostavljen zraku in je tudi zelo strupen.
Beli fosfor pri temperaturi pri 250 ° C postane rdeč fosfor; polimerna oblika, netopna in ta ne gori v zraku. Pri visokih temperaturah in pritiskih, pa tudi v prisotnosti ali ne katalizatorjev, dobimo črni fosfor, ki spominja na grafit in je dober električni prevodnik.
 Beli fosfor, shranjen v steklenici z vodo. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Beli fosfor, shranjen v steklenici z vodo. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Fosfor je bil prvič izoliran s H. Blagovna znamka, leta 1669. Da bi to naredili, se urin uporablja kot vir tega elementa. Leta 1770, w. Scheele je odkril, da lahko tudi izolira kostni fosfor.
Kasneje zaradi ustvarjanja električne pečice J. Burgess Readman (1800), fosfatne kamnine so postale glavni vir proizvodnje fosforja iz fluoroapatitne rude, ki je prisoten v njih.
Fosfor je dvanajst bolj obilnega elementa Zemljine skorje in ga po teži predstavlja 0,1%. Poleg tega je v človeškem telesu šesti element v izobilju; v glavnem koncentrirano v kosteh v obliki hidroksilapatita.
Zato je bistveni element za živa bitja, ki postane ena od treh glavnih hranilnih snovi rastlin. Fosfor je del kemijske strukture nukleinskih kislin; spojin za shranjevanje energije (ATP), koencimi; in na splošno iz spojin presnove.
[TOC]
Zgodovina
- Odkritje
V urinu
 Joseph Wright iz Derby Painting, kjer prikazuje odkrivanje fosforja. Vir: Joseph Wright iz Derbyja [javna domena]
Joseph Wright iz Derby Painting, kjer prikazuje odkrivanje fosforja. Vir: Joseph Wright iz Derbyja [javna domena] Fosfor je leta 1669 izoliral Henning Brand, saj je bil prvi človek, ki je izoliral element. Blagovna znamka je bila nemški alkimist iz Hamburga in je uspela pridobiti fosforjevo spojino iz urina. Da bi to naredil, je zbral urin s 50 vedri in mu omogočil, da se razgradi.
Blagovna znamka je nato izhlapela urin in pridobila črni ostanek, ki je zadržal več mesecev. V to dodano pesek in ga ogrel, pri čemer je uspelo odpraviti pline in olje. Končno je dobil belo trdno snov, ki je v temi sijala z zeleno barvo, ki jo je imenoval "hladen ogenj".
Izraz "fosfor", naključno izvira iz grške besede "fosforos", kar pomeni nosilca svetlobe.
Blagovna znamka ni objavila svojih eksperimentalnih rezultatov in jo prodala več alkimistom, med njimi: Johann Kraft, Kunckel Lowenstern in Wilhelm Leibniz. Verjetno so nekateri od njih poročali o blagovni znamki Akademiji Pariza in tako razširjali njihove preiskave.
Vendar blagovna znamka v resnici ni izolirala fosforja, ampak amoniakni natrijev fosfat [NH (NH4) Po4]. Leta 1680 je Robert Boyle izboljšal postopek Brand, s katerim je lahko pridobil alotropno obliko fosforja (P4).
V kosteh
Johan Gottlieb Gahn in Carl Wihelm Scheele sta leta 1769 ugotovila, da je bila fosforjeva spojina, kalcijev fosfat, v kosteh. Nesrečne kosti so bile podvržene procesu prebave z močnimi kislinami, kot je žveplova kislina.
Nato smo prebavni izdelek segrevali v jeklenih posodah s premog in premog, s čimer smo dobili beli fosfor z destilacijo v retortu. Kosti so bile glavni vir, ki je dobil fosfor do leta 1840, ko jih je v ta namen zamenjal Guano.
V Guanu
Guano je mešanica ptic ptic in njihovih produktov razgradnje. Uporabljali so ga kot vir fosforja in gnojil v 19. stoletju.
- Industrijski razvoj
Fosfatne kamnine so se leta 1850 uporabljale kot vir fosforja. To je skupaj z izumom električne pečice za Calcine The Rocks avtorja Jamesa Burgesa Readmana (1888) fosfatske kamnine postavilo glavno surovino proizvodnje in gnojil.
Leta 1819 so bile ustanovljene tovarne Cerrillas, ki so začele industrijski razvoj fosforja.
Fizikalne in kemijske lastnosti
Videz
Glede na alotropno obliko je lahko brezbarven, zaprti beli, rumeni, škrlatni, rdeči, vijolični ali črni.
Atomska teža
30.973 u
Atomsko število (z)
petnajst
Tališče
Beli fosfor: 44,15 ° C
Rdeči fosfor: ~ 590 ° C
Vrelišče
Beli fosfor: 280,5 ° C
Gostota (temperatura okolice)
Bela: 1.823 g/cm3
Rdeča: 2,2-2,34 g/cm3
Vijolična: 2,36 g/cm3
Črna: 2,69 g/cm3
Fuzijska toplota
Beli fosfor: 0,66 kJ/mol
Toplota za uparjanje
Beli fosfor: 51,9 kJ/mol
Molarna kalorična sposobnost
Beli fosfor: 23.824 j/(mol.K)
Stanja oksidacije
-3, -2, -1, +1, +2, +3, +4 in +5
Odvisno od elektronegativnosti elementov, s katerimi lahko fosfor pokaže stanje oksidacije +3 ali -3. Fosfor, za razliko od dušika, ponavadi reagira prednostno s stanjem oksidacije +5; Takšen je primer fosforjevega pentoksida (P2Tudi5 ali p25+Tudi52+).
Vam lahko služi: topni materialiElektronegativnost
2.19 na lestvici Pauling
Ionizacijska energija
-Prvi: 1.101 kJ/mol
-Drugi: 2.190,7 kJ/mol
-Tretjič: 2.914 kJ/mol
Toplotna prevodnost
Beli fosfor: 0,236 w/(m · k)
Črni fosfor: 12,1 w/(m · k)
Pokaže, kako črni fosfor deluje skoraj šestkrat več toplote kot beli fosfor.
Magnetni vrstni red
Bele, rdeče, vijolične in črne tekme so diamagnetne.
Izotopi
Fosfor ima 20 izotopov, ki so glavni: 31P, edini stabilen izotop z obilico 100%; 32P, emitter β izotop- in s polovičnim življenjem 14,28 dni; in 33P, izotop β emitterja- In s pol življenja 25,3 dni.
Fosforescenca
Beli fosfor je fosforescenten in oddaja zeleno luč v temi.
Alotropne spremembe
Beli fosfor je nestabilen in spremeni temperature, ki so blizu 250 ° C do polimerne oblike, znane kot rdeči fosfor, ki se lahko spreminja oranžno do vijolično oranžno. To je amorfna snov, vendar lahko postane kristalna; Ne sije v temi ali gori v zraku.
Beli fosfor pri visokih temperaturah in pritiskih ali v prisotnosti katalizatorjev se pretvori v polimerno obliko, ki ni rdeč fosfor: črni fosfor. To je črna, inertna kristalna snov, podobna grafitu, in to ima sposobnost vodenja električne energije.
Topnost
Beli fosfor čisti je netopen v vodi, čeprav ga je mogoče solubilizirati v ogljikovem sulfidu. Medtem so rdeče in črne tekme netopne v vodi in so manj hlapne kot beli fosfor.
Reaktivnost
Fosfor se spontano gori v zraku, da tvori P2Tudi5, In to lahko reagira s tremi molekulami vode, da tvori ortofosforno ali fosforno kislino (H3Po4).
Z delovanjem vroče vode izvira iz fosfina (pH3) in fosforjeve oksicide.
Fosforjeva kislina deluje na fosfatirane kamnine, ki povzročajo dihidrogen ali superfosfat kalcijev fosfat [CA2Po4)2].
Lahko reagirate s halogeni, da oblikujete px halogenide3, predstavlja x do f, cl, br ali i; o haluros s PX formulo5, Biti x, cl ali br.
Prav tako fosfor reagira s kovinami in metaloidi, da povzroči fosfide, in žveplo, da tvori več sulfidov. Po drugi strani se veže na kisik, da nastane estri. Na enak način je kombiniran z ogljikom, da tvori fosforne organske spojine.
Elektronska struktura in konfiguracija
- Povezave in tetraedrska enota
Atomi fosforja imajo naslednjo elektronsko konfiguracijo:
[NE] 3S2 3P3
Zato je pet elektronov iz Valencije, na primer dušik in drugi elementi skupine 15. Ker gre za nemetalni element, morajo njeni atomi oblikovati kovalentne vezi, dokler se okteto de Valencia ne dokonča. Dušik ga doseže, kadar je uveljavljen kot datomične molekule n2, S trojno povezavo, n≡n.
Enako velja za fosfor: dva njega P atoma sta povezana s trojno vezjo, da tvorita p molekulo2, P≡P; To je difosfor alotrop. Vendar ima fosfor večjo atomsko maso kot dušik, njegove 3P orbitale, bolj razpršene kot 2p dušika, se prekriva z manj učinkovitosti; Zato je P2 Obstaja le v plinasti stanju.
Namesto tega pri sobni temperaturi Atomi P raje kovalentno organizirajo na drug način: v tetraedrski molekuli P4:
 P4 Molekularne enote v kristalih belega fosforja. Vir: Benjah-BMM27 prek Wikipedije.
P4 Molekularne enote v kristalih belega fosforja. Vir: Benjah-BMM27 prek Wikipedije. Upoštevajte, da imajo na vrhunski sliki vsi a atomi tri preproste povezave namesto trojne povezave. Tako fosfor v p4 Dokončajte svojo okto de Valencia. Vendar v P4 V P-P povezavah je napetost, saj se njihovi koti odpravljajo na golo oko 109,5 °.
- Alotropi
Beli fosfor
Ista podoba P enot4 In njegova nestabilnost pojasnjuje, zakaj je beli fosfor najbolj nestabilen alotropni v tem elementu.
Enote str4 Naročeni so v prostoru, da v normalnih pogojih določijo kristal BCC (faza α). Ko se temperatura spusti na -77,95 ° C, se BCC steklo pretvori v HCP (predvidoma), gostejši (β faza). Se pravi, P enote4 Naročene so v dveh nadomestnih slojih, A in B, da vzpostavijo zaporedje ABAB ..
Rdeči fosfor
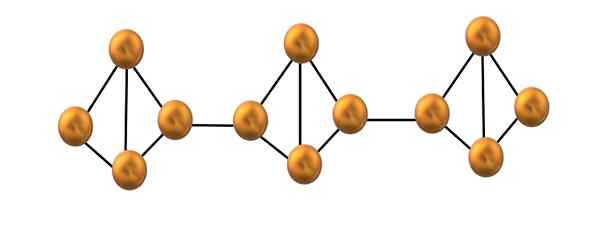 Rdeča struktura verige fosforja. Vir: Gabriel Bolívar.
Rdeča struktura verige fosforja. Vir: Gabriel Bolívar. Na zgornji sliki je prikazan le majhen segment strukture rdečega fosforja. Ker so tri enote poravnane "simetrično", lahko rečemo, da gre za kristalno strukturo, ki jo dobimo s segrevanjem tega fosforja nad 250 ° C.
Rdeči fosfor pa je večino časa sestavljen iz trdne amorfne, tako da je njegova struktura zmedena. Torej, polimerne verige P4 Imeli bi brez navideznega vzorca, enega zgoraj in druge pod isto ravnino poljubno.
Upoštevajte, da je to glavna strukturna razlika med belim in rdečim fosforjem: v prvem4 So individualni in v drugih oblikovnih verigah. To je mogoče, ker je v tetraednu razbit ena od P-P povezav, da se lahko poveže s sosednjim tetraedronom. Tako se obročasta napetost in rdeči fosfor zmanjšata več stabilnosti.
Vam lahko služi: cink: zgodovina, lastnosti, struktura, tveganja, uporabeKadar je mešanica obeh alotropov, je na voljo na vidiku kot rumeni fosfor; Mešanica verig tetraedre in amorfnih fosforja. Pravzaprav beli fosfor.
Vijolični ali hittorski fosfor
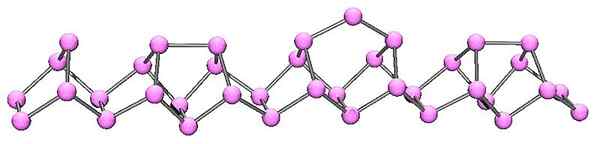 Molekularna struktura vijoličnega fosforja. Vir: kadmij v angleški Wikipediji [javna domena]
Molekularna struktura vijoličnega fosforja. Vir: kadmij v angleški Wikipediji [javna domena] Vijolični fosfor je končni razvoj rdečega fosforja. Kot je razvidno iz vrhunske slike, še naprej sestavlja polimerna veriga; Toda zdaj so strukture bolj zapletene. Zdi se, da strukturna enota ni več P4 Toda p2, razporejeni tako, da tvorijo nepravilne peterokotne obroče.
Kljub temu, kako asimetrična je struktura videti, te polimerne verige uspejo dovolj dobro naročiti.
Črni fosfor
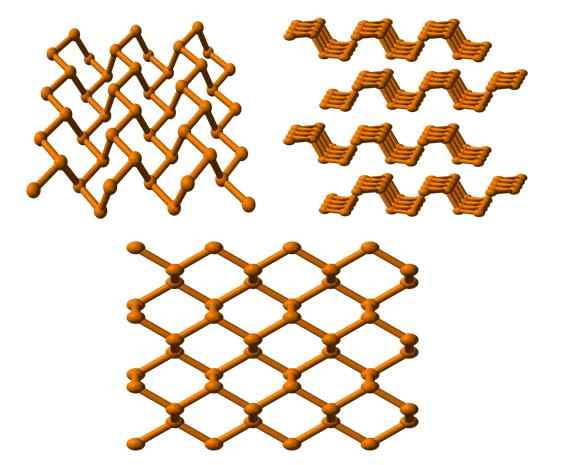 Črna struktura fosforja, ki jo vidimo iz več zornih kotov. Vir: Benjah-BMM27 [javna domena].
Črna struktura fosforja, ki jo vidimo iz več zornih kotov. Vir: Benjah-BMM27 [javna domena]. In končno imamo najbolj stabilen fosforno alotrope: črna barva. Pripravi beli fosfor pod pritiskom 12.000 atm.
Na zgornji sliki (spodaj) je razvidno, da ima njegova struktura z višje ravnine določeno podobnost grafitu; To je strma mreža šesterokotnih obročev (čeprav so videti kvadratni).
V zgornjem levem kotu slike lahko bolje cenite novo komentirane. Molekularna okolja P atomov so trigonalna piramida. Upoštevajte, da je pogled strukture bočno (zgornji desni vogal), razporejeno v plasteh, ki ustrezajo drugemu.
Struktura črnega fosforja je precej simetrična in urejena, kar se strinja s svojo sposobnostjo, da se uveljavi kot ortorramski kristali. Z zlaganjem njegovih polimernih slojev P atomi niso na voljo za številne kemijske reakcije; In zato je bistveno stabilen in malo reaktiven.
Čeprav ga ni treba omeniti, so londonske disperzijske sile in molarne mase teh fosforičnih trdnih snovi tiste, ki urejajo nekatere njegove fizikalne lastnosti; Medtem ko njihove strukture in vezi P-P določajo kemijske lastnosti in druge.
Kje je in dobimo
Apatita in fosforit
To je dvanajst elementa Zemljine skorje in predstavlja 0,1% po teži. Obstaja približno 550 mineralov, ki vsebujejo fosfor, apatita pa je najpomembnejši mineral za pridobivanje fosforja.
Apatita je mineral fosforja in kalcija, ki lahko vsebuje spremenljive količine fluorida, klorida in hidroksida, katerih formula je naslednja: [CA10(Po4)6(F, CL ali OH)2). Poleg apatita obstajajo tudi drugi fosforjevi minerali komercialnega pomena; Takšen je primer Wavelita in Vivianita.
Fosfatna ali fosforitna skala je glavni vir fosforja. To je nedetritna sedimentna skala, ki ima 15-20% vsebnost fosforja. Fosfor je običajno prisoten kot ca10(Po4)6F2 (fluoroapatita). Prisoten je tudi kot hidroksiapatit, čeprav v manjši meri.
Poleg tega lahko fluoroapatit najdemo del magnetnih in metamorfnih kamnin, pa tudi apnenci in skrilavca.
Elektrotermalno zmanjšanje fluoroapatite
Izbrane fosfatne kamnine se prenesejo v čistilno napravo za predelavo. Sprva so zdrobljeni, da bi dobili skalne fragmente, ki so nato zmleti v krogličnih mlinih pri 70 revolucijah na minuto.
Nato je izdelek brušenja kamnitih drobcev, da bi jih lahko razdelil. Te frakcije so izbrane s 34% vsebnostjo fosforja, kot je fosforni pentoksid (P2Tudi5).
Beli fosfor (P4) Industrijsko ga dobimo z elektrotermalnim redukcijo fluoroapatita z ogljikom pri temperaturi 1.500 ° C v prisotnosti silicijevega oksida:
2CA3(Po4)2(s) + 6SIO2(s) + 10 c (s) => p4(g) + casio3(L) + co (g)
P4 V plinastem stanju se po kondenzaciji zbira in shrani kot bela trdna snov, potopljena v vodo, da prepreči reakcijo z zunanjim zrakom.
Zlitine
Coppery
Pokrov fosforja je izdelan z različnimi odstotki bakra in fosforja: Cu 94 % - p 6 %; Cu 92% - P 8%; Cu 85% - P 15% itd. Zlitina se uporablja kot deoksidant, vlažilno sredstvo za bakreno industrijo in tudi kot nukleant v aluminijasti industriji.
Broncin
So baker, fosfor in kositrne zlitine, ki vsebujejo 0,5 - 11% fosforja in 0,01 - 0,35% kositra. Kositer poveča korozijsko odpornost, medtem ko fosfor.
Uporablja se pri izdelavi izvirov, vijakov in na splošno v člankih, ki zahtevajo utrujenost, obrabo in kemično korozijo. Priporočljiva je njegova uporaba v plovilu propelerjev.
Vam lahko služi: kadmij (cd): zgodovina, lastnosti, struktura, uporabeNicterladas
Najbolj znana zlitina je bradavicadvajset, Z uporabo fosforiranega niklja v močnih zlitinah varilnic za izboljšanje njegove odpornosti na kemično erozijo, oksidacijo in visoke temperature.
Zlitina se uporablja v komponentah za plinske in reakcijske motorje, galvanoplastika in pri proizvodnji varilnih elektrod.
Tveganja
Beli fosfor proizvaja resne opekline kože in je močan strup, ki je lahko smrten pri odmerku 50 mg. Fosfor zavira celično oksidacijo, posega v celično obvladovanje kisika, kar lahko privede do degeneracije maščob in smrti celice.
Akutna zastrupitev s fosforjem nastane v prvih štirih dneh od sesalne bolečine v trebuhu, goreč, dih z vonjem česna, fosforescentno bruhanje, znojenje, mišične krče in celo šok stanja.
Kasneje se manifestirajo zlatenica, petehiae, krvavitev, miokardna naklonjenost z aritmijo, sprememba centralnega živčnega sistema in smrt na deseti dan vnosa.
Najbolj očitna manifestacija kronične zastrupitve s fosforjem je poškodba kostne strukture čeljusti.
Povečanje koncentracije fosforja v plazmi (hiperfospatija) je običajno predstavljeno pri bolnikih z odpovedjo ledvic. To povzroča nenormalno nahajališče fosfatov v mehkih tkivih, kar lahko privede do vaskularne disfunkcije in srčno -žilne bolezni.
Prijave
Fosfor je bistven element za rastline in živali. Je eno od treh glavnih hranilnih snovi rastlin, ki so potrebna za njihovo rast in energijsko potrebo. Poleg tega je del nukleinskih kislin, fosfolipidov, vmesnih produktov presnovnih procesov itd.
V vretenčarjih je fosfor prisoten v kosteh in zobeh v obliki hidroksilapatita.
- Osnovni fosfor
 Škatla tekem ali "fosfor". Vir: pxhere.
Škatla tekem ali "fosfor". Vir: pxhere. S fosforjem se izdeluje kemična sklenina, ki se uporablja za osvetlitev obvestil, nameščenih na aluminiju in njegovih zlitinah; kot tudi v bakrenem in fosforiranem bronu.
Uporablja se tudi za izdelavo zažigalnih bomb, granat, dimnih črpalk in sledilcev nabojev. Rdeči fosfor se uporablja pri izdelavi varnostnih tekem ali tekem.
Beli fosfor se uporablja za izdelavo organofosfata. Poleg tega se uporablja pri proizvodnji fosforne kisline.
Velika količina proizvedenega fosforja se sežiga za proizvodnjo fosforja tetraksida (P4Tudi10), pridobljeno kot prah ali trdno snov.
- Spojine
Fosfin
To je surovina za izdelavo več fosforjevih spojin. Deluje kot dopinško sredstvo za elektronske komponente.
Fosforna kislina
Uporablja se pri izdelavi brezalkoholnih pijač zaradi značilnega okusa, ki jim daje. Delujejo na fosfatne kamnine, da tvorijo dihidrogeni kalcijev fosfat2Po4)2], znan tudi kot superfosfat, ki se uporablja kot gnojilo.
Fosforna kislina je elementarni balzam zobne sklenine, ki olajša oprijem materialov njegove obnove. Uporablja se tudi, pomešano z oljem, sečnino, odmorom, bitumen in pesek, da tvori asfalt; Material, ki se uporablja pri popravilu kopenskih komunikacijskih kanalov.
Organofosfor
Organofosforjeve spojine imajo številne aplikacije; Na primer: zaviralci plamenov, pesticidi, ekstrakcijska sredstva, sredstva za živce in čiščenje vode.
Dihidrat dihidrat kalcijev fosfat
Uporablja se kot gnojilo, pecilni prašek, aditiv za živalsko hrano in pri izdelavi zobnih past.
Fosfor pentoksid
Uporablja se v kemični analizi kot dehidralno sredstvo in v organski sintezi kot kondenzator. Spojina je namenjena predvsem za proizvodnjo ortofosforne kisline.
Natrijev tripolifosfat
Uporablja se v detergentih in kot mehčalec vode, kar izboljša delovanje detergentov in pomaga preprečiti korozijo cevi.
Trisodni fosfat
Uporablja se kot čistilno sredstvo in mehčalec vode.
Natrijevi fosfati
Dibasični natrijev fosfat (NA2HPO4) in monobazični natrijev fosfat (ne2Po4) so sestavni deli sistema pH absorberja, ki celo deluje v živih bitjih; Med njimi človeška bitja.
Reference
- Reid Danielle. (2019). Alotropi fosforja: oblike, uporabe in primer. Študij. Okrevano od: študij.com
- Prof. Robert J. Lancashire. (2014). Predavanje 5c. Struktura elementov, nadaljujte p, s in i. Okrevano od: kem.Uwimona.Edu.Jm
- ByJU's. (2019). Fosfor rdeča. Okreval od: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang in drugi. (2019). Elektronske strukturne in optične lastnosti večplastnega modrega fosforja: študija prvega načela. Journal of Nanomaterials, Vol. 2019, ID članka 4020762, 8 strani. doi.org/10.1155/2019/4020762
- Doktor. Testo Stewar. (2019). Dejstva o elementih fosforja. Kemikool. Okrevano od: Chemicool.com
- Wikipedija. (2019). Fosfor. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (3. julij 2019). Dejstva fosforja (atomska številka 15 ali simbol elementa P). Okreval od: Thoughtco.com
- Inštitut Linus Pauling. (2019). Fosfor. Okreval od: LPI.Oregonstate.Edu
- Bernardo Fajardo P. & Héctor Lozano V. (s.F.). Nacionalna predelava fosfornih kamnin za proizvodnjo superfosfata. [PDF]. Okrevano od: bdigital.a i.Edu.co
- Uredniki Enyclopeedia Britannica. (16. november 2018). Kemični element fosforja. Encyclopædia Britannica. Okrevano od: Britannica.com
- Read International Corp. (2018). Bakreni fosfor (skodelica) zlitina. Okrevano od: Reade.com
- KBM Affilips. (27. december 2018). Nikelj fosfor (NIP) Master Alloy. Azom. Okreval od: azom.com
- Lentech b.V. (2019). Tabela obdobja: fosfor. Okrevano od: Lentech.com
- Abhijit naik. (21. februar 2018). Uporaba fosforja. Okrevano od: ScienceStruck.com
- « Manometrična razlaga tlaka, formule, enačbe, primeri
- Izvor, značilnosti, religija, kultura Trincheras »

