Sekundarna struktura značilnosti beljakovin

- 3332
- 885
- Roman Schamberger
The Sekundarna struktura beljakovin To je ime, ki določa konformacijo, zloženo lokalno nekaterih delov polipeptidne verige. Ta struktura je sestavljena iz več vzorcev, ki se redno ponavljajo.
Obstaja veliko načinov, na katere so zložene verige beljakovin. Vendar je le nekaj teh oblik zelo stabilne. V naravi so najpogostejše oblike, ki jih beljakovine pridobijo. Te strukture je mogoče opisati s koti povezave ψ (Psi) in φ (PHI) aminokislinskih odpadkov.
 Shema in model kroglic in palic alfa vijačnice beljakovin (sekundarna struktura). Vzeto in urejeno od: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Shema in model kroglic in palic alfa vijačnice beljakovin (sekundarna struktura). Vzeto in urejeno od: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Interakcije, vzpostavljene med stranskimi verigami aminokislinskih odpadkov, lahko pomagajo stabilizirati ali nasprotno destabilizirati sekundarno strukturo beljakovin. Sekundarno strukturo lahko opazimo v ustavi številnih vlaknastih beljakovin.
[TOC]
Zgodovina
V desetletju 30 -ih prejšnjega stoletja je William Atsbury, ki je sodeloval z X -Rays, ugotovil, da so v svojih strukturnih segmentih, ki so se redno ponavljali.
Na podlagi teh rezultatov in z znanjem o pomenu vodikovih vezi pri orientaciji polarnih skupin peptidnih vezi, Williama Pauling -a in sodelavcev, so posledično hipotetično določili možne redne konformacije, ki bi jih lahko imeli proteini.
Pauling in njegovi sodelavci so v petdesetih letih prejšnjega stoletja vzpostavili več postulatov, ki jih je bilo treba izpolniti v povezavah polipeptidnih verig, vključno z in na prvem mestu, da se dva atoma ne moreta približati na razdalji, manjši od njihove oddaljenosti od njihove oddaljenosti od njihove razdalje od njihove oddaljenosti radijski sprejemniki Van der Waals.
Prav tako so navedli, da so za stabilizacijo zlaganja verig potrebne nekovalentne povezave.
Vam lahko služi: spolna reprodukcijaNa podlagi teh postulatov in prejšnjih znanj in z uporabo molekulskih modelov jim je uspelo opisati nekatere redne konformacije beljakovin, vključno z, ki so bili pozneje dokazani, da so najpogostejše narave, kot sta propeler α in lamina β β β.
Propeler α
Je najpreprostejša sekundarna struktura, kjer je polipeptidna veriga razporejena v valjani in stisnjeni obliki okoli namišljene osi. Poleg tega izstopajo stranske verige vsake aminokisline iz tega vijačnega okostja.
Aminokisline so v tem primeru razporejene tako, da imajo kote povezave ψ Od -45 ° do -50 ° in φ od -60 °. Ti koti se nanašajo na povezavo med α ogljikom in kisikom karbonila ter vez med dušikom in α ogljikom vsake aminokisline.
Poleg tega so znanstveniki ugotovili, da je za vsak α propelerski zavoj predstavljen 3,6 aminokislinske odpadke in da je ta obrat vedno dekstrogir pri beljakovinah. Poleg tega, da je najpreprostejša struktura, je α propeler prevladujoča oblika v α-Queratinas in približno 25% aminokislin krogličnih beljakovin sprejme to strukturo.
Propeler α je stabiliziran zaradi dejstva, da predstavlja številne vodikove mostove. Tako se v vsakem zavoju propelerja vzpostavijo tri ali štiri tovrstne povezave.
V vodikovih mostovih je dušik peptidne vezi in kisikovega atoma karbonilne skupine naslednjih aminokislin v interakciji.
Znanstveniki so pokazali, da lahko α propeler oblikujemo s polipeptidnimi verigami, ki jih tvorijo L- ali D-aminokisline, s pogojem, da imajo vse aminokisline enako konfiguracijo stereozomera. Poleg tega lahko naravne L-aaminokisline tvorijo α Droords z desno in levo.
Vam lahko služi: imunoglobulin dVendar pa vsi polipeptidi ne morejo tvoriti stabilnega α propelerja, ker njihova primarna struktura vpliva na stabilnost tega. R verige nekaterih aminokislin lahko destabilizirajo strukturo in tako preprečijo nastanek propelerjev α.
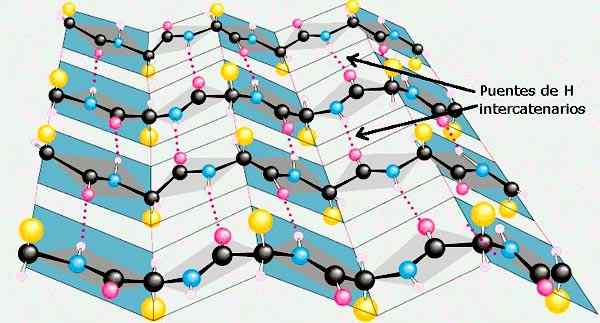
Β list
V β listom ali zloženem β listu ima vsak od aminokislinskih odpadkov 180 ° vrtenje glede na predhodni ostanek aminokisline. Na ta način je pridobljeno kot rezultat, da se okostje polipétidne verige razširi in v cikcak ali harmonikarni obliki.
Polipeptidne verige v obliki akorda v obliki akorda se lahko namestijo med seboj in proizvajajo linearne vodikove mostove med obema verigama.
Dve sosednji polipeptidni verigi sta lahko vzporedno razporejeni, torej obe lahko usmerjeni v smeri amino -karboksila, ki tvori vzporedno β listo; o Lahko se nahajajo v nasprotnih smereh, nato pa tvorijo β Antiparalla list.
Bočne verige sosednjih aminokislinskih odpadkov izstopajo iz okostja verige v nasprotnih smereh, kar povzroča izmenični vzorec. Nekatere beljakovinske strukture omejujejo vrste aminokislin β struktur.
Na primer, v gosto pakiranih beljakovinah so aminokisline kratke verige, kot sta glicin in alanin na njihovih kontaktnih površinah.
 Β list sekundarnih struktur beljakovin. Vzeto in urejeno od: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Β list sekundarnih struktur beljakovin. Vzeto in urejeno od: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Druge skladnosti sekundarne strukture
Vijak 310
Za to strukturo je značilno, da predstavimo 3 aminokislinske odpadke na krog. Ta struktura je bila opažena pri nekaterih beljakovinah, vendar po naravi ni zelo pogosta.
Vijak π
Ta struktura ima medtem 4,4 aminokislinske odpadke iz spiralnega zavoja in 16 -elementov vodikove zanke. Čeprav je ta konfiguracija sterilno mogoča, je v naravi nikoli ni bilo opaziti.
Vam lahko služi: krompirjev agar dekstroze: temelj, priprava in uporabaMožen vzrok za to je lahko votlo središče, preveliko, da bi omogočilo delovanje sil Van der Waals, ki bi pomagale stabilizirati strukturo, in vendar je premajhen, da bi omogočil prehod molekul vode.
Struktura SupersCundaria
Nadzorni strukturi so kombinacije sekundarnih struktur α in zloženih listov β β listov. Te strukture se lahko pojavijo v številnih krogličnih beljakovinah. Obstajajo različne možne kombinacije, od katerih ima vsaka posebne značilnosti.
Nekaj primerov struktur SuperSecundarias je: enota βαβ, v katerem sta dva vzporedna β lista povezana s segmentom propelerja α; the enota αα, za katerega sta značilna dva zaporedna αices, vendar ločena z ne -heličnim segmentom, povezanim s združljivostjo njegovih stranskih verig.
Več β listov se lahko umakne na sebi, kar daje konfiguracijo sod β, medtem ko se je antipaallala β plošča umaknila, ali predstavlja strukturo Supersecundaria, imenovano Grški ključ.
Reference
- C.K. Mathews, k.In. Van Hold & K.G. Ahern (2002). Biokemery. 3. izdaja. BENJAMIN / CUMSINGS Publishing Company, Inc.
- R.Murray, str. Mayes, d.C. Granner & v.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange.
- J.M. Berg, j.L. Tymoczko & L. Stryer (2002). Biokemery. 5. izdaja. W. H. Freeman in družba.
- J.Koolman & k.-H. Roehm (2005). Atlas biokemijske barve. 2. izdaja. Tiem.
- Do. Lehninger (1978). Biokemija. Omega Editions, s.Do.
- T. McKee & J.R. McKee (2003). Biokemija: Molekularna osnova življenja. 3Rd Izdaja. McGraw-hiii Companies, Inc.
- « Elastični pretresi v dimenziji, posebnih primerih, vajah
- Karakteristike trenutne vrednosti, formule in primeri »

