Absorpcijski spekter

- 3576
- 20
- Roman Schamberger
 Vidni svetlobni spekter. Vir: Wikimedia Commons
Vidni svetlobni spekter. Vir: Wikimedia Commons Kaj je absorpcijski spekter?
A Absorpcijski spekter Je produkt interakcije svetlobe z materialom ali snovjo v katerem koli od njegovih fizičnih stanj. Interakcija vključuje širok segment območja valovnih dolžin in energije elektromagnetnega sevanja.
Z drugimi besedami, absorpcijski spekter odraža, da del elektromagnetnega sevanja, ki ga določen material absorbira v frekvenčnem območju.
V tem smislu lahko nekatere trdne snovi, tekočine ali plini absorbirajo fotone različnih energij ali valovnih dolžin, iz ultravijoličnega sevanja, ki ji sledi vidna svetloba, do sevanja ali infrardeče svetlobe, ki se v mikrovalovnih valovnih dolžinah osupne.
Človeško oko zaznava samo interakcije snovi z vidno svetlobo. Prav tako je sposoben razmišljati o difrakciji bele svetlobe skozi prizmo ali medij v svojih barvitih komponentah (vrhunska slika).
Če je lahki žarek "ulov", potem ko je potoval skozi material in analiziral, bi našli odsotnost določenih barvnih pasov. To pomeni, da bi opazili črne črte v nasprotju z njegovim ozadjem.
To je absorpcijski spekter, njegova analiza pa je temeljna v instrumentalni analitični kemiji in astronomiji.
Atomska absorpcija
Na zgornji sliki je prikazan tipičen absorpcijski spekter elementov ali atomov. Upoštevajte, da črne črte predstavljajo absorbirane valovne dolžine, druge. To pomeni, da bi bil atomski spekter atomskega oddajanja videti kot črni pas z oddajanimi barvami.
Kaj pa so te črte? Kako vedeti, ali atomi absorbirajo ali oddajajo (ne da bi uvedli fluorescenco ali fosforescenco)? Odgovori so v elektronskih stanjih, ki jih dovoljujejo atomi.
Vam lahko služi: Minimalna formula: Kako pridobiti minimalno formulo, primere in vajeElektronski prehodi in energija
Elektroni se lahko oddaljijo od jedra, tako da se med potovanjem iz nižje energijske do ene večje energije pusti pozitivno naložiti. Če želite to narediti, razloženo s kvantno fiziko, absorbirajo fotone specifične energije za izvedbo omenjenega elektronskega prehoda.
Zato je energija kvantizirana in ne bo absorbirala medija ali treh četrtin fotona, ampak frekvenčne vrednosti (ν) ali betonskih valovnih dolžin (λ).
Ko je elektron navdušen, ne ostane neomejen v elektronskem stanju večje energije. Sprostite energijo v obliki fotona in atom se vrne v svoje bazalno ali izvirno stanje.
Odvisno od tega, ali so zabeleženi absorbirani fotoni, bo obstajal absorpcijski spekter. In če se zabeležijo izdani fotoni, bo rezultat emisijski spekter.
Ta pojav lahko opazimo eksperimentalno, če se mehki ali atomizirani vzorci segrejejo iz elementa. V astronomiji je mogoče vedeti sestavo zvezde in celo njegovo lokacijo, povezano z zemljo.
Vidni spekter
Kot je razvidno iz slike, vidni spekter vključuje barve od vijolične do rdeče in vse njegove odtenke glede na to, koliko materiala absorbira (temni odtenki).
Valovne dolžine rdeče svetlobe ustrezajo vrednostim 650 nm naprej (dokler ne izginejo v infrardečem sevanju).
In na levem koncu vijolični in vijolični toni pokrivajo vrednosti valovne dolžine do 450 nm. Vidni spekter nato pokriva od 400 do približno 700 nm.
Ko se λ povečuje, se frekvenca fotona zmanjšuje in s tem tudi njena energija. Tako ima vijolična svetloba večjo energijo (nižje valovne dolžine) kot rdeča svetloba (višje valovne dolžine).
Vam lahko služi: bromova: zgodovina, struktura, elektronska konfiguracija, lastnosti, uporabeZato material, ki absorbira vijolično svetlobo, pomeni elektronske prehode večjih energij.
Ko material absorbira vijolično barvo, bo nosil zelenkasto rumeno barvo, kar pomeni, da njegovi elektroni izvajajo zelo energijske prehode. In ko material absorbira rdečo barvo, manj energije, bo odražala modrikasto zeleno barvo.
Kadar je atom zelo stabilen, ponavadi predstavlja zelo oddaljena elektronska stanja v energiji in bo zato moral absorbirati fotone večje energije, da se omogoči elektronski prehodi:
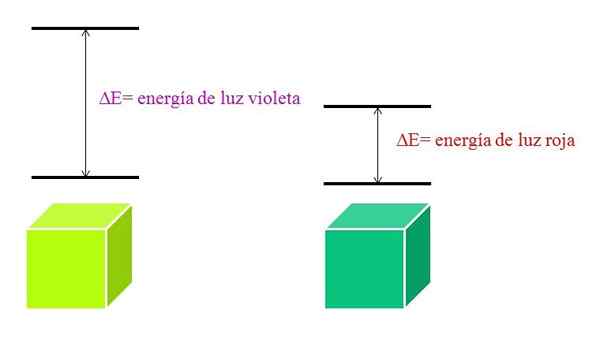 Shema energije vijolične svetlobe in rdeče svetlobe. Vir: Gabriel Bolívar
Shema energije vijolične svetlobe in rdeče svetlobe. Vir: Gabriel Bolívar Absorpcijski spekter molekul
Molekule imajo atome, ki absorbirajo tudi elektromagnetno sevanje. Vendar so njihovi elektroni del kemične vezi, zato so njihovi prehodi različni. Eden od velikih zmag molekulske orbitalne teorije je, da lahko povezava absorpcijske spektre s kemijsko strukturo.
Tako imajo preproste, dvojne, trojne, konjugirane povezave in aromatične strukture svoja elektronska stanja, ki absorbirajo zelo specifične fotone.
Z posedovanjem več atomov, poleg medmolekulskih interakcij in vibracij njihovih povezav (ki absorbirajo tudi energijo), imajo molekulske absorpcijske spektre obliko "gora", ki kažejo na pasove, ki vključujejo valovne dolžine, kjer elektronski prehodi.
Zahvaljujoč tem spektrom lahko spojino označimo, prepoznamo in celo z multivariatno analizo količinsko opredelimo.
Metilen modra
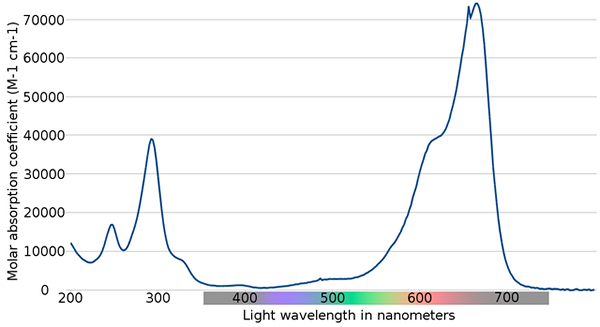 Metilen modri spekter. Vir: Wikimedia Commons
Metilen modri spekter. Vir: Wikimedia Commons Na zgornji sliki je prikazan spekter modrega metilenskega indikatorja. Kot poudarja njegovo ime, je modra, vendar ga je mogoče preveriti s svojim absorpcijskim spektrom?
Vam lahko služi: fizične spremembeUpoštevajte, da obstajajo pasovi med valovnimi dolžinami 200 in 300 nm. Med 400 in 500 nm skoraj ni absorpcije, torej ne absorbira vijolične, modre ali zelene barve.
Vendar pa predstavlja intenziven absorpcijski pas po 600 nm in ima zato nizkoenergijske elektronske prehode, ki absorbirajo fotone rdeče svetlobe.
Posledično in glede na visoke vrednosti molarnih absorbcij ima metilen modra intenzivno modro barvo.
Klorofili a in b
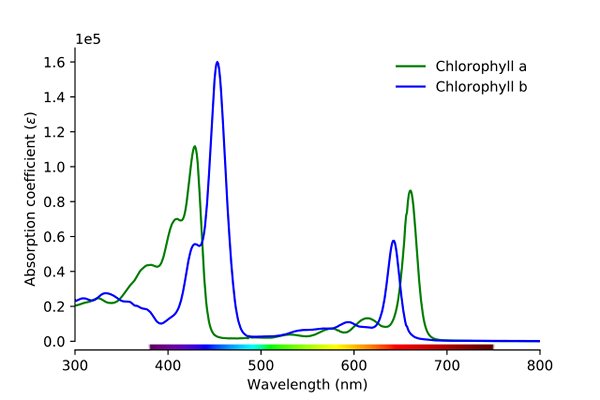 Klorofil absorpcijski spekter A in B. Vir: Wikimedia Commons
Klorofil absorpcijski spekter A in B. Vir: Wikimedia Commons Kot je razvidno iz slike, zelena črta ustreza absorpcijskemu spektru klorofila, modra črta.
Prvič, pasovi, kjer so molarne absorpcije višje, v tem primeru tisti, ki so na levi, med 400 in 500 nm. Klorofil A intenzivno absorbira vijolične barve, medtem ko klorofil B (modra črta) to počne z modro barvo.
Z absorpcijo klorofila B okoli 460 nm (modra) se odbija rumena barva. Po drugi strani pa tudi intenzivno absorbira približno 650 nm, oranžno svetlobo, kar pomeni, da ima barvo modro. Če sta rumena in modra mešana, ima za posledico zeleno barvo.
In končno, klorofil absorbira modrikasto vijolično barvo in tudi rdečo luč okoli 660 nm. Zato ima rumeno barvo zeleno "mehko" barvo.
Reference
- Observatoire de Paris.F.). Različne vrste spektrov. Pridobljeno v povprečju4.OSPPM.fr
- Univerzitetni kampusi Ranals.F.). Spektrofometrija: absorpcijski spektri in kolorimetrična kvantifikacija biomolekul. UCO je okreval.je

