Kemična vez
- 3665
- 802
- Cary Goyette
Pojasnjujemo, kaj so kemične povezave, vrste, ki obstajajo, in dajemo veliko primerov
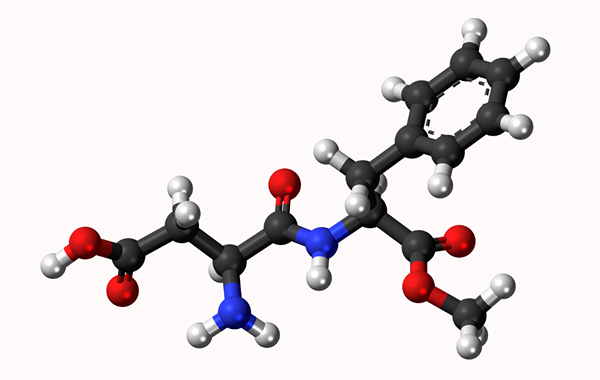
 Molekularni model Aspartamo: Preprosta povezava, ki jo predstavljata črta in dvojna vez z dvema vrsticama. Kroglice so atomi
Molekularni model Aspartamo: Preprosta povezava, ki jo predstavljata črta in dvojna vez z dvema vrsticama. Kroglice so atomi Kaj je kemična vez?
A Kemična vez To je sila, ki se drži skupaj z atomi spojine. Sila, ki združuje atome, je elektromagnetna, in ko so atomi vezani, ohranijo svojo naravo.
Na primer, običajna voda se tvori zaradi združitve dveh vodikovih atomov (h2) in eden od kisika (o); Zato je njegova kemična formula h2Tudi. Čeprav so združeni, da tvorijo vodo, vodikovi atomi ostajajo vodik in kisik je še vedno kisik.
Spomnimo se, da atome tvori jedro, obkroženo z oblakom elektronov, ki imajo negativno obremenitev. Jedro atoma ima pozitiven naboj, ki uspe pritegniti elektrone.
Vendar pa elektrone privlačijo tudi jedra drugih atomov. Tako nastanejo kemične povezave. Dejstvo, da atomi dajejo ali delijo elektrone, ustvarja različne vrste kemičnih povezav.
V kemičnih veznih donosnosti atomov, osvojijo ali delijo elektrone tistega, kar se imenuje Valencia plast, ki je najbolj oddaljena plast atoma, kjer se pojavlja reaktivnost, ali nagnjenost k tvorbi kemičnih vezi.
Te povezave naredijo nove snovi (ne mešanic), ki jih ni mogoče ločiti s tehnikami, kot sta sito ali filtriranje.
Vrste kemičnih vezi
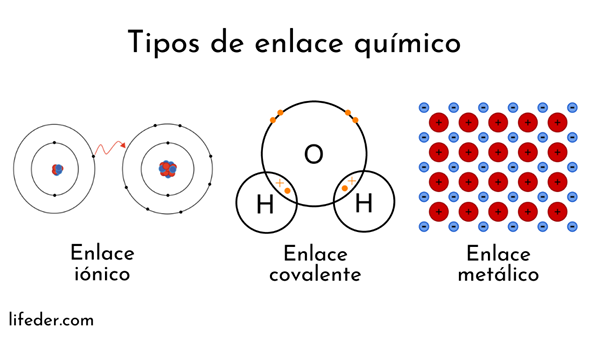
Atomi tvorijo jedro (s pozitivnim električnim nabojem) in elektroni (delci z negativnim električnim nabojem), ki se vrtijo naokoli. Obe strani se vmešata v kemične vezi.
Kemične vezi, ki vključujejo atomska jedra, se imenujejo kovinske. Po drugi strani so tisti, ki vključujejo izmenjavo elektronov, razdeljeni na ion in kovalentno.
Vam lahko služi: klorobenzen (C6H5Cl)Ionske povezave
Ta vrsta povezave je zelo odporna; proizvaja trdne kemične spojine (kristale) v vodi in z visoko tališčem (med 300 in 1.000 stopinj Celzija). Raztopljeni v vodi, so električni vodniki.
Kako so ionske povezave?

Ionske vezi se pojavljajo med kovino in ne -kometalom, ki imajo drugačno elektronegativnost (sposobnost privabljanja elektronov). Elektroni plasti Valencije enega atoma prehajajo na drugega atoma Valencije. Ki je enako; Kovinski atom daje elektron nemetalnemu atomu, ki dosega elektronsko stabilnost.
V celotnem oblikovanju povezav so oblikovani ioni (kationi in anioni), od tod tudi ime ionske vezi.
Primer te vrste vezi je natrijev klorid: ta kemična spojina nastane, ko klor (CL) privabi elektron valenčne plasti, ki ima atom natrija (NA).
Drug primer je manganov klorid (MGC), ki se uporablja pri izdelavi slik in razkužilnih sredstev. Zaradi kemične vezi elektrone manganovega atoma absorbirajo atom klora.
Kovalentne povezave
Kovalentne vezi so zelo trde in ustvarjajo netopne kemične spojine z visoko fuzijsko temperaturo (več kot 1.000 stopinj Celzija). Ne izvajajo električne energije.
Glede na način, kako atomi delijo svoje elektrone, so lahko kovalentne vezi:
- Preprosto: Imajo nekaj elektronov (a-a).
- Dvojno: Delite dva elektrona para (a =).
- Trojna: Delite tri elektronske pare (A≡A).
Kako se tvorijo kovalentne vezi?

Kovalentna vez se oblikuje, ko dva nemetalna elementa delita elektrone svoje valenčne plasti.
Lahko vam služi: Rubidio: Zgodovina, lastnosti, struktura, pridobivanje, uporabeIzmenjava elektronov se vedno pojavi tako, da je v skladu z oktetnim zakonom. To je kemično načelo, ki navaja, da je najbolj stabilna konfiguracija za atom tista, v kateri ima osem elektronov v svoji najbolj oddaljeni plasti.
Primer kovalentne vezi je voda (h2Da). Za ustvarjanje molekule vode sta potrebni dve preprosti kovalentni vezi. V preprosti vezi se vodikov elektron deli s kisikom, kisik pa ima elektron z vodikom.
Drug primer kovalentne obveznice je ogljikov dioksid (CO2), eden glavnih, odgovoren za učinek toplogrednih plinov in podnebne spremembe. Če želite oblikovati to spojino, ogljik in kisik ustvarita dve dvojni vezi, torej za vsako povezavo dva para elektronov delita.
Kovinske povezave
Ta vrsta povezave se zgodi samo v kovinskih elementih. Sestavljen je iz združenja jeder dveh atomov istega kovinskega elementa skupaj z njihovimi elektroni.
Za kovinske povezave so značilni učinkoviti električni vodniki, ki imajo zelo visoko fuzijsko in vrelišče ter enostavno oksidirani. So tudi poševni in odporni na praske, zelo trdne in močne.
Kako so kovinske povezave?
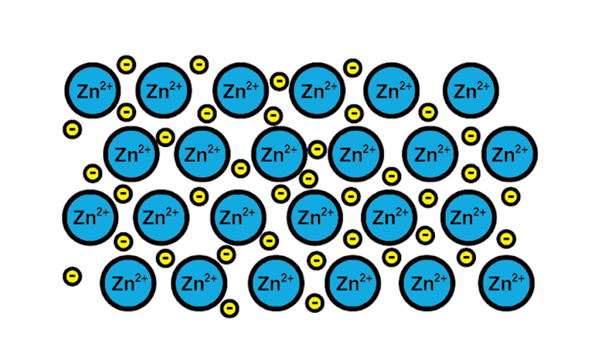 Cinkova kovinska povezava
Cinkova kovinska povezava Primer kovinske povezave je cinka, kovinski element. Proces usposabljanja te vrste povezave je:
1-atoško jedro kovinskega elementa ustreza drugemu jedru istega elementa.
2-Elektroni plasti Valencije obeh jeder postanejo morje elektronov naokoli. To pomeni, da ne krožijo niti enega atomskega jedra.
3-Privabljajo se pozitivne obremenitve atomskih jeder in negativnosti elektronov. Rezultat so valenčni elektroni, ki tvorijo morje elektronov okoli atomskih jeder (kationi).
Lahko vam služi: bakreni sulfat (CuSO4): struktura, lastnosti, pridobivanje, uporabePrimeri kemične vezi
Ionske povezave
- Barijev oksid (BAO).
- Magnezijev klorid (MGCL2).
- Kalcijev oksid (CAO)
- Srebrni nitrat (Agno3)
- Cinkov hidroksid (ZnOH2)
- Kalijev bromid (KBR)
- Kalcijev karbonat (caco3)
- Bakreni sulfat (cuo4)
- Litijev fluorid (lif)
- Manganski klorid (MNCL2)
- Kalijev sulfat (k2SW4)
- Železni oksid (grd)
- Disodijev fosfat (NA2HPO4)
- Kalijev joduro (ki)
Kovalentne povezave
- Ogljikov dioksid (co2)
- Amonijak (NH3)
- Parafin (CNH2N+2)
- Dizel (c12H26)
- Dibromo (br2)
- Ogljikov monoksid (CO)
- Butano (c4H10)
- Benzen (c6H6)
- Molekularni dušik (n2)
- Metan (pogl4)
- Klorovodikova kislina (HCl)
- Cianhidrična kislina (HCN)
Kovinske povezave
Vsaka kovina v svojem čistem stanju je primer kovinske povezave, in sicer:
- Nikelj (ni)
- Železo (vera)
- Aluminij (Al)
- Titan (ti)
- Svinec (PB)
- Kobalt (co)
- Baker (Cu)
- Cink (Zn)
- Živo srebro (HG)
- Zlato (au)
- Srebro (AG)
- Barium (BA)
Pomen kemičnih vezi
Pomen kemičnih vezi je, da tvorijo organske in anorganske molekule, na ta način pa so del baze vseh živih organizmov. Če so podvrženi določenim pogojem, lahko te povezave prekinejo. Ta energija se imenuje Povezava energija.
Nekatere tehnike za razbijanje povezav uporabljajo elektrika, visoke temperature ali izzvanje kemijskih reakcij z različnimi spojinami.
Na primer, da ločite molekule kisika in vodika od H2Lahko pa na vodo nanesemo elektriko, ki je postopek, znan kot elektroliza.
Kemične spojine, ki jih tvori povezava, so številne in so prisotne v vsakdanjem življenju. Sol, ki jo uporabljamo za začinjeno hrano, je kemični sestavljeni produkt povezave med natrijem (NA) in enim atomom klora (Cl) (CL). Njegova kemična formula je NACL, ki bere natrijev klorid.

