Kaj je najbolj elektronegativni element in zakaj?

- 1139
- 320
- Dexter Koch
 Najbolj elektronegativni element je fluorid (F), zaklenjen v rdečem krogu
Najbolj elektronegativni element je fluorid (F), zaklenjen v rdečem krogu On Več elektronegativnega elementa V periodični tabeli je fluor, katere kemikalija je f in spada v halogensko skupino. Med vsemi elementi periodične tabele je fluorid najbolj zaskrbljen, da zajame elektrone iz drugih atomov.
Ta element, plinast pri sobni temperaturi, je zelo reaktiven, zato ga ni enostavno najti v čistem stanju v naravi. Fluor se zlahka poveže z drugimi elementi, kot so žveplo, kalcij in kovine, pa tudi s številnimi spojinami, zlasti tistimi, ki vsebujejo vodik.
Njegova visoka elektronegativnost vam omogoča, da se celo kombinirate z plemenitimi plini, kot so Xenon, Kripton in Radon.
Po fluoru je kisik drugi element z najvišjo elektronegativnostjo. V nasprotju s tem sta elementi z najnižjo elektronegativnostjo Francio (FR) in Cezija (CS).
 Ker je najbolj elektronegativni element, fluor tvori številne spojine, kot sta fluorit ali kalcijev fluorid. Vir: Wikimedia Commons
Ker je najbolj elektronegativni element, fluor tvori številne spojine, kot sta fluorit ali kalcijev fluorid. Vir: Wikimedia Commons Te so torej največ Elektropozitivno ki obstajajo, čeprav je Francio radioaktiven in zelo malo v naravi.
Elektronegativnost in periodična tabela
Lestvico elektronegativnosti je razvil kemik in nagrada Nobel Linus Pauling (1901-1994), čeprav je koncept posledica švedskega kemika Jöns Jakob Berzelius (1779-1848).
Pauling lestvica, ki elektronegativnosti dodeli dimenzijske številčne vrednosti, se uporablja za merjenje intenzivnosti, s katero atom privabi elektron drugega drugačnega atoma, in tako tvori povezave.
Vsak element ima svojo elektronegativnost, ki je odvisna od atomskih lastnosti. Določen je eksperimentalno in posredno, na primer merjenje energije povezave, kot je to storil Pauling okoli leta 1932.
Na lestvici Pauling Electronegaties je Fluorid prvi, s približno vrednostjo 3.98 ≈ 4.0.
Vam lahko služi: alifatski ogljikovodiki: lastnosti, nomenklatura, reakcije, vrsteElektronegativnost je periodična lastnost elementov. V večini primerov (obstaja nekaj izjem), opazimo, da se elektronegativnost poveča, ko se premika od leve proti desni po vrstah periodične tabele.
In tudi povečanje od spodaj navzgor, s premikanjem na stolpcu.
 Periodična tabela elektronegativnosti v skladu z lestvico Pauling. Fluorin je najbolj elektronegativni element, ki se nahaja zgoraj in na desni, medtem ko je Francio najmanj elektronegativni od vseh ali najbolj elektropozitiven, če je prednostno, in je v levem in navzdol stolpcu. Vir: f. Zapata.
Periodična tabela elektronegativnosti v skladu z lestvico Pauling. Fluorin je najbolj elektronegativni element, ki se nahaja zgoraj in na desni, medtem ko je Francio najmanj elektronegativni od vseh ali najbolj elektropozitiven, če je prednostno, in je v levem in navzdol stolpcu. Vir: f. Zapata. Fluor elektronegativnost
Razlog, da je fluor najbolj elektronegativni element v periodični tabeli, je posledica njegove elektronske konfiguracije (način, kako so njeni elektroni razporejeni v orbitalah okoli jedra).
Ta konfiguracija je 1s22s22 p5, Torej ima fluorid 5 elektronov v svoji najbolj oddaljeni plasti.
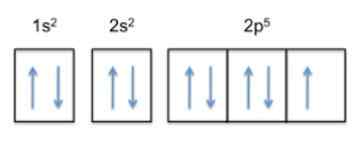
Ker je trend atoma dokončati svojo zunanjo plast, to pomeni, da bo fluor z veliko lahkoto sprejel elektron drugih atomov, da bi pridobil stabilnost in spominjal na plemeniti plin iste vrstice, ki je neonski , katerih elektronska konfiguracija je 1s22s22 p6.
Atom fluora ima zelo majhen polmer, saj protoni v njihovem jedru privabljajo elektrone zelo močno, pri čemer jih držijo bližje kot v atomih manj elektronegativnih elementov, kot sta Cessium in Francia.
Zato so slednji pripravljeni enostavno odpovedati elektronom, da bi oblikovali povezave.
Reference
- Aguilar, c. Vodnik za enoto za kemično učenje i. Pridobljeno iz: ipn.mx.
- Atkins, str. (2005). Načela kemije, poti odkritja. 3. mesto. Izdaja. Pan -american Medical uredništvo.
- Clark, j. Elektronegivnost. Okrevano od: kem.Librettexts.org.
- Hein, m. (2014). Temelji kemije na fakulteti. 14. izd. Wiley.
- Lentech. Kemični elementi, ki jih ureja njegova elektronegativnost. Okrevano od: Lentech.je.

