Notranja energija

- 4107
- 1090
- Dexter Koch
Pojasnjujemo, kaj je notranja energija, njegova funkcija, kako jo izračunati in navesti več primerov
 Diagram, ki prikazuje prispevke za notranjo energijo sistema. Vir: f. Zapata
Diagram, ki prikazuje prispevke za notranjo energijo sistema. Vir: f. Zapata Kaj je notranja energija?
The notranja energija Iz predmeta izvira iz naključnega gibanja, ki ga imajo atomi in molekule, ki ga sestavljajo. Tudi ko je predmet popolnoma v mirovanju, v notranjosti, na mikroskopski ravni, se delci, ki ga sestavljajo, neprekinjeno premikajo brez počitka.
Ker se ti delci premikajo, imajo kinetično energijo, kar je del njihove notranje energije. Drugi prispevek k notranji energiji je potencialna energija, ki izvira iz medmolekulskih sil, odgovorne za ohranjanje kohezije snovi.
Te medmolekularne sile so običajno iz elektromagnetnega izvora, vendar sodelujejo tudi gravitacijske in jedrske sile.
Zdaj, odvisno od vrste gibanja delcev, je lahko kinetična energija:
- Translacijski
- Vibracijski
- Rotacijski
Temperatura meri samo translacijsko kinetično energijo delcev. Načeloma bo pri večji temperaturi notranja energija večja, vendar je to odvisno tudi od mase. A primer Vprašanje pojasnjuje: kozarec s toplo vodo ima manj notranje energije kot jezero pri sobni temperaturi, čeprav je temperatura kozarca višja, in to je zato, ker je v jezeru več vode kot v steklu.
Vsekakor notranja energija snovi ni opazna, ni odvisna od njegovega gibanja, niti ni odvisna od njegovega relativnega položaja glede na druge predmete. Na primer, notranja energija kozarca z vodo pri sobni temperaturi je enaka, če je kozarec na mizi ali če je na tleh.
Vam lahko služi: ne -koplanarni vektorji: definicija, pogoji, vajeFunkcija notranje energije
Notranja energija, ki je običajno označena kot U, je funkcija, ki je odvisna od termodinamičnih spremenljivk sistema, kot sta temperatura T in Volume V. Zato se lahko matematično izrazi kot:
U = u (t, v)
V resnici absolutna vrednost notranje energije sistema ni pomembna, pomembna je njegova variacija, ki je označena z grško črko Δ ("Delta"):
ΔU = u začetno - Ali finale
Zdaj je mogoče notranjo energijo spreminjati, če se toplota doda ali izvleče. Če dodate toploto, je mogoče, da sistem opravi določeno delo, na primer bat v cilinderju motorja.
Prvi zakon termodinamike
Iz prvega zakona termodinamike je ugotovljeno Nihanje notranje energije Iz sistema, ki ustreza:
ΔU = Q - W
Kjer je količina toplote, ki se prenese v sistem in W, je delo, ki ga opravlja sistem, v primeru, da nekaj izvede. Vse se meri v Joulesu v mednarodnem sistemu enot.
Če sistem ne deluje, se v celoti uporablja dobava toplote za povečanje notranje energije sistema.
Iz prejšnjega izraza izhaja naslednje:
- ΔU> 0 pomeni, da sistem poveča svojo notranjo energijo
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Sistem absorbira toploto
- W> 0 Sistem deluje.
Kako izračunati notranjo energijo?
Monoatomski idealni plin
V modelu monoatomskega idealnega plina (en sam atom) delci ne delujejo med seboj, tako da je translacijska kinetična energija edini prispevek k notranji energiji ali plinu. Obstaja teorem, imenovan Teorem o opremi, ki navaja, da ima vsaka stopnja svobode energijo, ki je enaka:
Lahko vam služi: valovna difrakcija: koncept in primeriKjer je T temperatura in R je konstanta idealnih plinov, katerih vrednost v enotah mednarodnega sistema je:
8.314472 j/mol ∙ k
Stopnja svobode predstavlja možnost premika po določeni smeri v vesolju. Idealen delček plina se lahko premika v treh smereh prostora, zato je energija n molov plina:
Količina toplote
Ob predpostavki, da se toplota doda v sistem in to ne deluje, se ta toplota uporablja le pri povečanju notranje energije sistema. Količina toplote, ki mora biti sorazmerna z maso m sistema, in spremembami temperature:
Q ∝ M⋅ΔT
Konstanta sorazmernosti je odvisna od snovi in se imenuje Specifična toplota. Klicanje C k tej konstanti je toplota:
Q = mc⋅ΔT
Ker se toplota spremeni pri povečanju notranje energije:
Q = mc⋅ΔT = ΔU
ΔU ustreza variacija V notranji energiji.
Primeri notranje energije
1. Temperaturne razlike
Spremembe temperature snovi posledično ustvarjajo spremembe v njihovi notranji energiji. To se zgodi na primer pri kuhanju. S segrevanjem hrane se vznemirjenje njegovih molekul povečuje, kinetična energija se poveča in zato naredi svojo notranjo energijo.
2. Notranja energija dveh snovi pri isti temperaturi
Dve snovi pri isti temperaturi nimata nujno enake notranje energije, saj je odvisna od dveh prispevkov: kinetične energije in potencialne energije.
Če so snovi pri isti temperaturi, je mogoče potrditi, da je translacijska kinetična energija njegovih delcev enaka, vendar je potencialna energija drugačna, saj je to odvisno od konfiguracije sestavnih atomov.
Vam lahko služi: hidrostatični tlak: formula, izračun, primeri, vaje3. Toplotno raztezanje
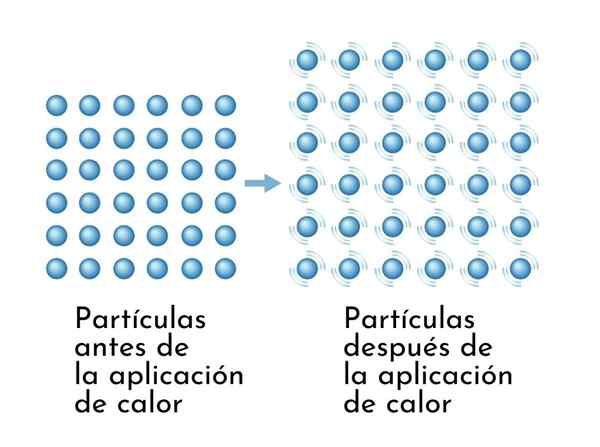 Snovi se pri segrevanju razširijo, saj povečanje notranje energije povzroči širše vibriranje njihovih delcev, zato se dimenzije povečujejo
Snovi se pri segrevanju razširijo, saj povečanje notranje energije povzroči širše vibriranje njihovih delcev, zato se dimenzije povečujejo Vidna posledica ogrevalnih snovi je povečanje njihovih dimenzij, saj se povprečna razdalja med atomi poveča.
Intermolekularne sile je mogoče simulirati skozi vzmeti, ki združujejo atom.
4. Stisnjeni plini
Stisnjeni plini lahko shranijo notranjo energijo, saj se njihova gostota poveča z zmanjšanjem volumna in z njim interakcije s stenami posode zabojnika. Na ta način lahko stisnjen plin opravi delo, kot je premikanje bata.
5. Baterije
V bateriji se kemične reakcije lahko ustvarijo električni tok takoj, ko se vezje zapre. Ta kemična potencialna energija velja za del notranje energije sistema.
6. Sistem, ki absorbira toploto in deluje
Ko sistem absorbira toploto, poveča svojo notranjo energijo. Če pa hkrati opravi delo, lahko prvi zakon termodinamike uporabimo, da vemo, koliko spreminja notranje energije. Na primer, ob predpostavki, da sistem absorbira 175 j toplote in opravlja delo, ki ustreza 62 J, je sprememba njegove notranje energije:
ΔU = Q - W = 175 J - 62 J = 113 J.



