Notranji elektroni

- 1685
- 323
- Raymond Moen
Pojasnjujemo, kaj so notranji elektroni, njihove značilnosti in dajejo več primerov
Kaj so notranji elektroni?
Kadarkoli pomislimo na atom, si predstavljamo jedro, ki ga tvorijo protoni in nevtroni, obkroženi z elektroni, ki se vrtijo okoli njega, podobno kot kako se planeti vrtijo okoli sonca.
Niso pa vsi elektroni enaki in dva razreda je mogoče razlikovati, odvisno od tega, kako blizu ali daleč sta od atomskega jedra.
Nekateri so dlje od jedra in se imenujejo Valencia Electrons. Ti so odgovorni za vse kemijske reakcije, ki jih poznamo. Po drugi strani, Tisti, ki so najbližje jedru in so z njim močneje združeni, so tisti, ki jim pravimo notranji elektroni.
Značilnosti notranjih elektronov
So najbolj stabilni elektroni
Na splošno je nižja raven energije elektrona, to je bolj stabilno. Notranji elektroni zasedajo orbitale na najnižji ravni energije atoma, zato so tudi najbolj stabilni elektroni.
Močneje so združeni z jedrom
Jedro privlači elektrone, ker imata oba nasprotna obremenitev: jedro je pozitivno, medtem ko negativni elektroni. Ta sila se poveča, ko se razdalja zmanjšuje.
Zaradi tega so tudi notranji elektroni, ki so najbližje jedru, tudi tisti, ki so najmočneje povezani z istim. Iz istega razloga so tudi najtežji elektroni odstranjeni.
Niso del kemičnih vezi
Ko se en atom približa drugemu, je prva stvar, ki se jih je dotaknila. Zaradi tega se v kemijske reakcije vmešajo samo Valencia elektroni. Notranji elektroni niti ne sodelujejo v kemičnih vezjih, niti niso vključeni v kakršno koli kemijsko reakcijo.
Lahko vam služi: koliko kredanskih elektronov ima ogljik?Zelo so zaščitene
To pomeni, da notranji elektroni stojijo med zunanjimi elektroni in jedro, kar ustvarja nekakšen zaslon, ki zmanjšuje silo, s katerim jedro privlači elektrone valence.
Vedno pridejo v pari
V vsaki orbitali sta samo dva elektrona z nasprotnimi vrtljaji, ki se imenujeta seznanjeni elektroni (kar je še en način, da rečejo, da tvorijo par). Tako kot orbitale, kjer se nahajajo notranji elektroni, so vedno popolnoma polni, zato so ti elektroni vedno seznanjeni.
Kako vemo, koliko notranjih elektronov ima atom?
Vedeti, koliko notranjih elektronov ima atom, je zelo preprosto. Vedeti morate le, koliko elektronov ima atom in koliko teh elektronov pripada plasti Valencije. Vsi drugi elektroni so notranji elektroni.
Kako pa ugotovimo te številke? V naslednjih razdelkih to razložimo.
Skupno število elektronov je enako atomskemu številu
Ker so atomi nevtralni (torej nimajo neto električnega naboja), morajo imeti enako število pozitivnih obremenitev (protonov) kot negativne obremenitve (elektroni). Ker atomska številka kaže, koliko protonov je v jedru, zato tudi kaže, koliko elektronov je atom, ko je nevtralen.
V primeru ionov, ki imajo za razliko od atomov električni naboj, dobimo skupno število elektronov z odštevanjem atomskega števila, razen ionske obremenitve, z vsem in njihovim znakom.
Primeri
- Ogljikov atom (c) je element 6 periodične tabele (to je njegovo atomsko število). Zato ima ogljikov atom skupno 6 elektronov.
- Natrijev ion (i) (na+) ima pozitiven naboj +1 in atomsko število natrija je 11. Torej je skupno število elektronov tega iona: 11 - (+1) = 10 elektronov.
- Kloridni ion (Cl-) ima negativno obremenitev -1, atomsko število klora pa 17. Torej je skupno število elektronov tega iona: 17 - ( - 1) = 17 + 1 = 18 elektronov.
Valenciano število elektronov je enako njihovi skupini v periodični tabeli
Vsi elementi, ki spadajo v skupino 1A (alkalne kovine), imajo 1 elektron Valencije. Tisti, ki pripadajo 2. (Alkaliner), imajo 2, tiste iz 3. (Boro Group, Aluminium, Gallium itd.) Imajo 3 in tako naprej. To ne velja za prehodne kovine.
Tako kot prej se ioni odštejejo od izračuna njihovih valenčnih elektronov.
Primeri
- Kisik spada v skupino 6A za tisto, kar ima 6 valenčnih elektronov.
- Sulfidni ioni2-) Pripada tudi skupini 6A, vendar ima obremenitev -2, tako da ima: 6 -( -2) = 6 + 2 = 8 Valencia Electrons.
Primeri različnih atomov in njihovih notranjih elektronov
Notranji ogljikovi elektroni (c)

Kot smo videli že pred časom, ima Carbon skupaj 6 elektronov. Poleg tega spada v skupino 4A za tisto, kar ima 4 elektrone Valencije, tako da ima skupno 6 - 4 = 2 notranji elektroni.
Notranji dušikovi elektroni (n)
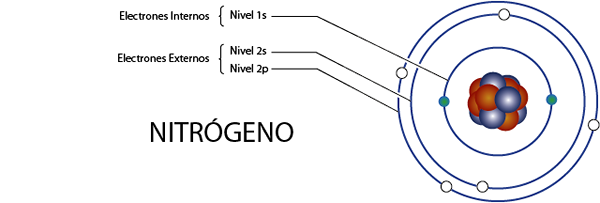
Dušik ima skupno 7 elektronov. Poleg tega spada v skupino 5A za tisto, kar ima 5 elektronov Valencije, tako da ima skupno 7 - 5 = 2 notranji elektroni.
Notranji elektroni argona (AR)
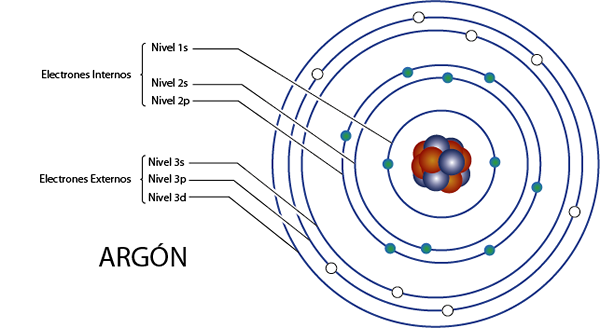
Argon je element 18 za tisto, kar ima skupno 18 elektronov. Poleg tega spada v skupino 8A za tisto, kar ima 8 elektronov Valencije, tako da ima skupaj 18 - 8 = 10 Notranji elektroni.
Notranji elektroni kloridnega iona (Cl-)
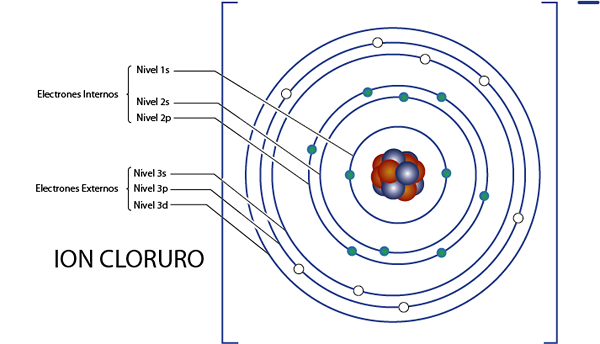
Kot smo videli pred trenutkom, ima klorid skupaj 18 elektronov. Poleg tega spada v skupino 7A in ima obremenitev -1, tako da ima 7 - ( - 1) = 8 Valencia elektronov. Torej ima 18 - 8 = 10 Notranji elektroni, Kot argon.
Lahko vam služi: jedrska kemija: zgodovina, področje študija, območja, aplikacijeNotranji elektroni kalcija +2 iona (CA2+)
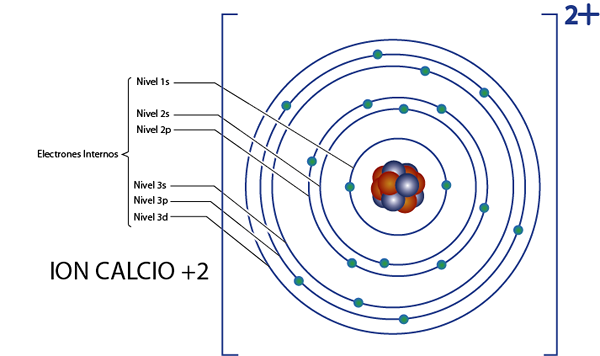
Kalcij je element 20, ta ion pa ima 2 pozitivna naboja, tako da ima skupno 20 - 2 = 18 elektronov okoli jedra. Ta element spada v skupino 2A in ker je njegova obremenitev +2, potem nima valenčnih elektronov (2 - 2 = 0). Zaradi tega je vseh 18 elektronov, ki jih je pustil kalcij, tisti, ki so bili prvotno notranji elektroni.
Obstajata dva elementa, ki nimata notranjih elektronov
Dva lažja elementa periodične tabele, ki sta vodik (H) in helija (He), imata le 1 oziroma 2 elektrona. Oba elektrona sta na edini ravni energije, ki jo imajo ti atomi, kar je 1. stopnja.
Zaradi tega ti elektroni ustrezajo valenčnim elektronom teh dveh elementov. Ker ni nižjih ravni energije, potem tudi notranjih elektronov ni.

