Delovanje kalomel elektrode, značilnosti, uporablja

- 4315
- 136
- Ignacio Barrows
On Kalomelna elektroda o Calomelanes je sekundarna elektroda, ki omogoča določitev potencialov pol življenja, zahvaljujoč reakciji med živosrebrom in živosrebrnim kloridom (I), HG2Cl2, prej znan kot kalomel. Oba reagenta, HG in HG2Cl2, Zmagajo ali izgubijo elektrone, odvisno od medija, v katerem je potopljena elektroda.
Običajno skrajšana kot EC, ta elektroda v številnih meritvah nadomešča standardno vodikovo elektrodo (SHE), saj je lažje graditi in manj tvegano za manipulacijo (čeprav ima živo srebro). V notranjosti vsebuje raztopino KCL kot elektrolitski medij za pretok elektronov.
 Kalomelna elektroda v popolni meritvi. Vir: Chandrajit Karmakar, CC BY-SA 4.0, prek Wikimedia Commons
Kalomelna elektroda v popolni meritvi. Vir: Chandrajit Karmakar, CC BY-SA 4.0, prek Wikimedia Commons Kalomelna elektroda ima lahko različne različice, odvisno od njegove velikosti ali pomembnejšega koncentracije KCl. Ko je raztopina KCL nasičena, govorimo o elektro kalomelu (ESC). ESC je lažje pripraviti kot ES, vendar bolj občutljiv na temperaturne spremembe.
Uporaba te elektrode je omogočila določitev polživih potencialov za nešteto redoksnih reakcij. To je tudi ponavljajoča se naprava pri potenciometričnih določitvah, ki želijo vedeti količino analita, odvisno od celice in izmerjenega potenciala.
[TOC]
Delovanje
Tako da deluje Calomelova elektroda, par HG-HG2Cl2 Morate reagirati, ne glede na to, ali boste zmagali ali izgubili elektrone.
Katodni
Ko se znižanje ali dobiček elektronov zgodi znotraj kalomelne elektrode, imamo naslednje reakcije:
Hg2Cl2 → Hg22+ + 2Cl- (Ionizacija)
Hg22+ + 2e- → 2HG (zmanjšanje)
Hg2Cl2 + 2e- → 2HG +2Cl- (Neto reakcija)
Vam lahko služi: eksotermična reakcijaZato HG2Cl2 Zmaga elektrone, ki se zmanjšajo na kovinsko živo srebro.
Potencial E elektrode, ko se zmanjša, je podana z enačbo:
E = Eº - 0.0591 dnevnik [cl-]
Kjer je opaziti, da je odvisno izključno od koncentracije Cl ionov-, je standardni potencial za to izmerjeno elektrodo pred standardno vodikovo elektrodo.
Anodni
Znotraj elektrode se lahko pojavi tudi postopek oksidacije:
2HG → Hg22+ + 2e- (Oksidacija)
Hg22+ + 2Cl- → Hg2Cl2 (Padavine)
2HG +2Cl- → Hg2Cl2 + 2e- (Neto reakcija)
To pomeni, da živo srebro oksidira, da ustvari več Hg2Cl2.
Potencialno E v tem primeru daje:
E = Eº + 0.0591 dnevnik [cl-]
In spet, in odvisno je od [cl-].
Splošna reakcija
Splošna reakcija za Calomelovo elektrodo je:
Hg2Cl2(s) + 2e- ⇌ 2HG (L) + 2Cl-
Občutek ravnotežja bo odvisen od medija, kjer je v stiku elektroda. Cl- Določite topnost HG2Cl2, kar posledično vpliva na tvorbo ali oksidacijo HG.
In potencial, določen za določeno koncentracijo ionov Cl- Enako bo:
Inkalomel = Emreža - Invol
Biti ekalomel Potencial, o katerem poročamo kot referenca v določenih potencialnih tabelah.
Značilnosti kalomelne elektrode
Predstavitev pol
Pol -rod Calomel Electrode je lahko predstavljen na naslednji način:
Pt | Hg | Hg2Cl2| Cl- (Xm)
Kjer je pomembna samo koncentracija ionov Cl-, izraženo v molarnosti ali normalnosti. Potencialni E elektrode se razlikuje, če je napolnjena z rešitvami različnih koncentracij KCl.
Na primer EC s KCL 0.1 m ima a in enako 0.3356 V pri 25 ° C; Medtem ko ima ESC z nasičenim KCL eno in enako 0.2444 V pri isti temperaturi.
Vam lahko služi: Isopentano: struktura, lastnosti, uporabe, pridobivanjeZato je koncentracija KCL najpomembnejša značilnost kalomelnih elektrod, saj bo pokazala, kaj uporabiti pri izvajanju izračunov potenciometričnih meritev.
Komercialno se dosežejo tri vrste kalomelnih elektrod: nasičene (ESC), devetnajste (0.1 N ali 0.1 m kCl) in normalno (1 n ali 1 m kCl). Elektroda kalomela 1 M KCl bi bila predstavljena kot:
Pt | Hg | Hg2Cl2| Cl- (1 m)
Zabave
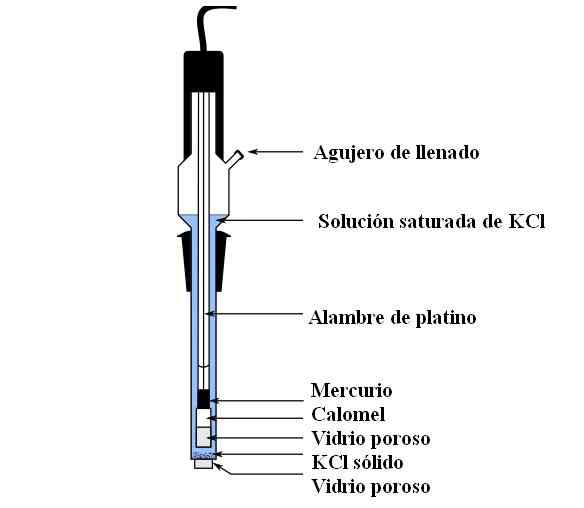 Deli kalomel elektrode. Vir: Bachi-Bouzou, CC0, prek Wikimedia Commons
Deli kalomel elektrode. Vir: Bachi-Bouzou, CC0, prek Wikimedia Commons Na zgornji sliki prikazujemo glavne dele navadne kalomelne elektrode. Narejena je iz stekla in je sestavljena iz dveh zabojnikov: zunanjega, ki je postavljen v elektrokemični stik z medijem meritev in vsebuje raztopino KCL; In notranje, kjer počiva mešanica HG-HG2Cl2.
Notranje elektroda Calomel vsebuje tekoče živo srebro, na kateri se drži Hg pasta2Cl2 navlažen z živo srebro. To je najbolj aktivna faza elektrode. Porozno steklo se uporablja za samo vstop ali izhod CL ionov-, Ne pa kristali HG2Cl2 ali kapljice živega srebra.
Platinasti kabel, kjer teče elektroni, je potopljen v živo srebro in je odgovoren za povezovanje elektrode z voltmetrom in zunanjim vezjem.
Skozi luknjo za polnjenje se vlije raztopina KCL, ki vsebuje odpade raztopine soli. Medtem imamo na dnu elektrode zelo majhno odprtino v poroznem steklu, ki pride v neposreden stik z medijem. Namen poroznega stekla je omogočiti stik brez nezaželenih izmenjav snovi, ki kontaminirajo elektrodo ali vzorec.
Lahko vam služi: cikloheksen: struktura, lastnosti, sinteza in uporabePrednosti
Kalomelna elektroda predstavlja naslednje prednosti glede na standardno vodikovo elektrodo:
-Enostavno graditi in manipulirati
-Njegov celični potencial ostane konstanten, tudi če voda izhlapi
-Ne potrebujete slane mostu
ESC je najlažje zgraditi iz kalomelnih elektrod, saj je KCL dovolj, da se raztopi, dokler se njihovi kristali ne oblikujejo. Potem bo raztopina nasičena in pripravljena za odlivanje v elektrodo.
Slabosti
Calomelova elektroda pa predstavlja naslednje slabosti:
-Z zadrževanjem tekočega živega srebra lahko negativno vpliva na okolje
-Ni ga mogoče uporabiti za kvantitativne analize v vzorcih s temperaturo, večjo od 60 ° C, saj HG2Cl2 začne se razgraditi, zaradi česar odčitavanje elektrod ne uspe
ESC ima tudi pomanjkljivost, da je zelo občutljiv na temperaturne spremembe.
Srebrna srebrna elektroda je v številnih potenciometričnih določitvah zamenjala kalomela.
Prijave
Calomelova elektroda je ena izmed številnih elektrod, ki se vsak dan uporabljajo pri potenciometričnih določitvah, kar omogoča pridobitev polživih potencialov analitov ali interesov, ki jih zanima.
Tudi kalomelna elektroda se uporablja pri pH meritvah in ciklični voltmetriji.
Reference
- Dan, r., & Underwood, a. (1986). Kvantitativna analitična kemija (Peti izd.). Pearson Prentice Hall.
- Wikipedija. (2020). Nasičena kalomelna elektroda. Pridobljeno iz: v.Wikipedija.org
- Splošno, Eni. (20. oktober 2018). Kalomel elektrode. Kemiji in slovar za hrvaško-England. KTF-Split. 30. oktober. 2020. Okreval od: slovarček.Periodin.com
- Skoog d.Do., Zahod d.M. (1986). Instrumentalna analiza. (Drugi izd.). Inter -American., Mehika.
- Hills, g., Ives, d. T. (1950). Kalomelna elektroda. Narava 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9. december 2012). Potenciometrija (ii): elektrode. Pridobljeno iz: Triplenlace.com
- « Značilnosti družbeno -kritičnih paradigmov, metode, predstavniki
- Osnove potenciometrije, enačbe, elektrode »

