Osnove potenciometrije, enačbe, elektrode
- 4334
- 778
- Ignacio Barrows
The Potentiometrija Gre za tehniko elektrokemične analize, ki temelji na merjenju napetosti, medija ali oddelka, s katerim se določi aktivnost ali koncentracija vrste (ionske ali molekularne). Gre za nedestruktivno tehniko, saj ne želi spremeniti kemijske narave zadevnega analita.
Za izvedbo te analize sta vsaj dve elektrodi nepogrešljivi: ena od referenc in drugega kazalca ali dela. Prav tako mora obstajati voltmeter z visoko impedanco, s katerim se merijo napetosti, ne da bi omogočili pomemben elektronski pretok med obema elektrodama in rešitvami, ki ju obkrožajo.
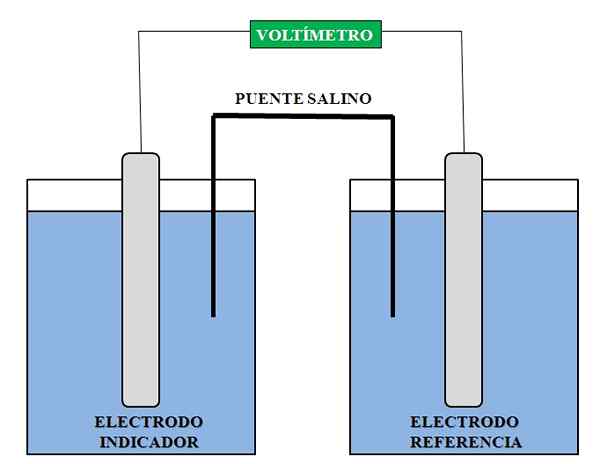
 Splošna predstavitev potrebnih elementov za potenciometrično analizo. Vir: Gabriel Bolívar.
Splošna predstavitev potrebnih elementov za potenciometrično analizo. Vir: Gabriel Bolívar. Zgoraj imamo splošno predstavitev sklopa za potenciometrično analizo. V predelu, kjer je uvedena indikatorska elektroda, je vrsta, katere koncentracija želimo določiti; Medtem ko imamo v referenčni elektrodi še eno rešitev, v kateri poznamo koncentracije njegovih komponent.
Registrirano odčitavanje napetosti načeloma mora vrsto, ki se približuje indikatorski elektrodi. S to napetostjo izračunamo koncentracijo te vrste, na primer koncentracijo Ca ionov2+, Ag+, H+, Na+, K+, Cl-, itd. Potentiometrija ima zato v klinični, okoljski, analitični in fizikalno -kemijski kemiji.
[TOC]
Osnove
Napetost, ki je določena v potenciometričnih analizah, je celica incelica, ki je razlika med napetosti, ki jih povzročata dve elektrodi, indikator in referenca. Elektrode so občutljive na aktivnosti molekul ali ionov, ki jih obkrožajo, saj jih lahko sprejmejo elektrone ali na nasprotni donosnosti.
Oba predela sta povezana, zato elektroda elektroda teče, kjer se redukcijo (katoda), na elektrodo, kjer poteka oksidacija (anoda) (anoda).
Vendar je ta prenos elektronov (ali toka) skoraj nič.
Vam lahko služi: vodikov bromid (HBR)Namesto tega voltmeter komaj dovoli prehod elektronov, tako da je stabilno odčitavanje napetosti in da lahko celica doseže termodinamično ravnovesje.
Zato se reče, da je potenciometrija nedestruktivna tehnika, ker se v merilni postopek spremeni malo ionov ali molekul, ki je tudi reverzibilno.
Glavne enačbe
Potencial celic
Potencial celice je povezan z dejavnostmi ali koncentracijami vrste, ki jih zanimajo, z Nernstovo enačbo:
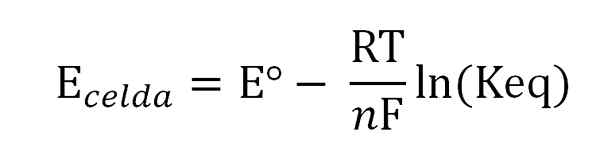 Nernstova enačba. Vir: Gabriel Bolívar.
Nernstova enačba. Vir: Gabriel Bolívar. Kjer je Eº potencial iste celice v standardnih pogojih, f Faraday Constant, n Število prenesenih elektronov, r plina konstanta in Keq konstanta ravnotežja globalne reakcije. Izračuni se opravijo s čiščenjem KEQ iz branja Ecelica, in izračun želene koncentracije izražanja ravnotežja.
Vendar je priročno izračunati koncentracije po lažji poti. Po konvenciji potencial celice daje tudi naslednjo enačbo:
Incelica = Emreža- Invol
Kjer je emreža To je potencial za redukcijsko pol -media, kjer se nahaja indikatorska elektroda; medtem ko evol Je potencial za oksidacijsko pol -media, kjer imamo referenčno elektrodo. Tako lahko enačbo prepišemo kot:
Incelica = Eindikator - Insklic + InJ
Biti eJ enako potencialu, ki ga povzročajo sklepi skupnega mostu. V praksi inJ Ni ga mogoče določiti, vendar zagotoviti, da je njegova vrednost čim bolj minimalna z uporabo zelo razredčenih rešitev ali zagotavljanje, da so sestave v obeh oddelkih podobne.
Potencial analita
Iz prejšnje enačbe lahko izračunamo inindikator, kar je potencial, ki nas resnično zanima. S to vrednostjo ponovno uporabimo Nernstovo enačbo:
Vam lahko služi: acetonitrile (C2H3N)Inindikator = Eº - (RT/NF) Ln (rdeča/vola)
Omrežje je zmanjšana oblika analita ali vrste, ki jih zanima, Ox pa je oksidirana oblika. Ob predpostavki, da je analit kations Zn2+ Na kovinski cinkovi elektrodi bi imeli:
Inindikator = EºZn2+/Zn - (Rt/nf) ln (1/doZn2+)
Kje doZn2+ To je dejavnost kationa Zn2+, ki je z eksperimentalnimi prilagoditvami precej blizu njene koncentracije [Zn2+]. Iz te enačbe se koncentracija Zn očisti2+, to, kot je razvidno, neposredno vpliva na vrednost Eindikator.
Zmanjšana oblika cinka, Zn, predstavlja aktivnost, enaka 1. Zato bo splošna enačba za zarjavele katione kovine, ki deluje kot elektroda, enaka:
Inindikator = EºMn+/m - (Rt/nf) ln (1/doM+n)
Toda to velja samo v primeru elektrod prvih vrst.
Elektrode
Elektrode so poleg voltmetra najpomembnejši elementi katere koli potenciometrične analize. Nekateri od njih bodo omenjeni spodaj.
Prve vrste
Prve vrste Elektrode so kovine, ki oksidirajo, da povzročajo katione in prenašajo elektrone do voltmetra. Nekatere od teh so naslednje: Ag, Zn, Cu, HG, SN, TL, CD in BI.
Niso vse kovine služijo kot prvi razredni elektrodi, ker ne smejo predstavljati kristalnih nepravilnosti ali površin, ki jih pokrivajo oksidne plasti, ki povzročajo nestabilne napetosti.
Druga vrsta
Po drugi strani so tudi druge vrste Elektrode vrst tudi kovinske, vendar vsebujejo tudi sol na njihovi površini, katere topnost je odvisna od redoks reakcij, ki potekajo. Na primer elektrode AG-AGCL in HG-HG2Cl2 (Calomel), so druge vrste elektrode.
Selektivni ioni
Selektivne ionske elektrode, znane tudi kot membrane, so tiste, ki so občutljive na določen ion ali molekulo, ki se prikrade skozi membrano, ki je zasnovana samo zanj, ki jo lahko prehaja, in ne druge vrste v raztopini.
Vam lahko služi: omejevanje in prekomerni reagentNajljubši primer te vrste elektrode je iz stekla, zgrajenega za določitev koncentracije H ionov3Tudi+ ali h+, In tako služi kot pehometer.
Uporaba potenciometrije
Okoljska kemija
Potentiometrija se uporablja pri okoljski kemiji pri določanju ionov CN-, F- in ne3-, pa tudi amoniak v vodnih tokovih.
Klinična kemija
Selektivne elektrode so zelo koristne, kadar so merilni mediji zapleteni. Zato bodo ostali ioni ali molekule ovirali odčitke.
Ta značilnost je še posebej koristna pri potenciometričnih določitvah, ki se izvajajo v istih celicah, kjer se mi vbrizgajo mikroelektrode, da se določi koncentracije K K+, Na+, Cl-, AC2+ ali h+.
Potenciometrične stopinje
Recimo, da je na sredini, kjer imamo indikatorsko elektrodo, dodan naslov A, ki reagira z analitom in zato spremeni svojo koncentracijo. Potem se bodo v E prišle do spremembcelica, ki bo na enak način ustrezala spremembam pH v titraciji kisline.
Tako grafikovanje incelica VS. VTitulant, Lahko določimo prelomnico ali enakovrednost in s tem bomo poznali koncentracijo analita.
Potentiometrične stopnje se pogosto uporabljajo v analitičnih in fizikalno -kemijskih laboratorijih za kemijo. Nekateri analiti, ki jih je mogoče določiti s to tehniko, so naslednje: Vera2+, HCO3-, AC2+, Mg2+, Cu2+, Askorbinska kislina, Haluros, med drugim.
Vse stopnje do neke mere lahko sledimo prek potenciometričnega, namesto da bi se zatekli k kazalnikom in njihovim končnim točkam.
Reference
- Dan, r., & Underwood, a. (1986). Kvantitativna analitična kemija (Peti izd.). Pearson Prentice Hall.
- Skoog d.Do., Zahod d.M. (1986). Instrumentalna analiza. (Drugi izd.). Inter -American., Mehika.
- Doktor. Doug Stewart. (2020). Opredelitev potenciometrije. Okrevano od: Chemicool.com
- Harvey David. (5. junij 2019). Potnometrične metode. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Britannica Encyclopeedia. (2020). Elektrogravimetrija. Okrevano od: Britannica.com
- Wikipedija. (2020). Elektroanalitične metode. Pridobljeno iz: v.Wikipedija.org
- « Delovanje kalomel elektrode, značilnosti, uporablja
- Spodbujanje vrst zdravil in njihove značilnosti »

