Elektrofilne reakcije, primeri, elektrofilnost
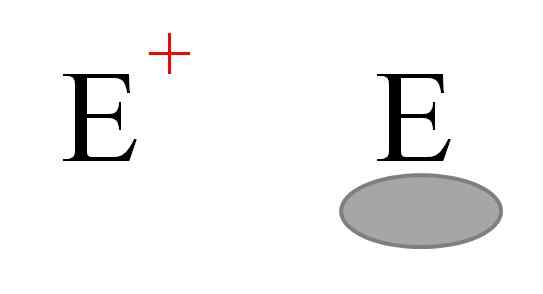
- 2093
- 240
- Ms. Pablo Lebsack
A Elektrofil Vse kemične vrste (atom ali molekula) je videti navdušeno nekaj elektronov. Beseda pomeni "ljubezen do elektronov". Zato bo elektrofija pri sodelovanju v kemičnih reakcijah vedno zmagala ali sprejemala elektrone.
Kaj naredi elektrofil, ki potrebuje elektrone? Morate imeti pomanjkanje elektronov, ne glede na to, ali se kaže delna ali skupna pozitivna obremenitev ali elektronski prosti produkt nepopolnega valenčnega okteta. To pomeni, da imamo več vrst elektrofilcev, čeprav vsi sprejemajo pare elektronov negativnih vrst.
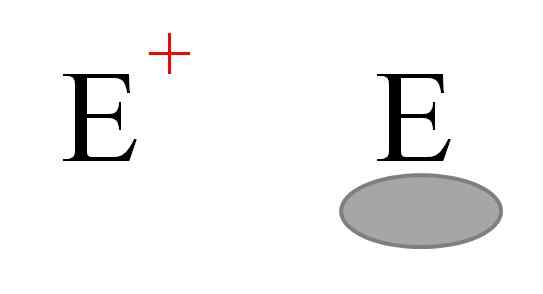 Dve najpogostejši vrsti elektrofilcev v kemiji. Vir: Gabriel Bolívar.
Dve najpogostejši vrsti elektrofilcev v kemiji. Vir: Gabriel Bolívar. Na splošno sta zastopani dve vrsti elektrofilcev. Oba sta simbolizirana s črko in. Tisti na levi ustreza pozitivni tovorni elektrofiji in+. Medtem tista na desni ustreza elektrofilu z elektronskim prostorom, ki ga predstavlja sivkasto oval, ki kaže na odsotnost elektronov v orbitali Valencije.
Kovinski kationi so primeri elektrofilcev in+, kot tudi nekaj poliatomičnih ionov, kot je hidronij, h3Tudi+. Alhove molekule3 in bf3, Po drugi strani so primeri druge vrste elektrofilcev, saj imata aluminij in atom bora pomanjkanje elektronov, ker ne dokončajo okteta Valencije.
[TOC]
Reakcije
Elektrofili reagirajo sprejemanje parov atomskih elektronov z visoko negativno gostoto, to je bogato z elektroni. Ti negativni atomi ali molekule se imenujejo nukleofili, NU-, ki podarijo nekaj elektronov za elektrofijo in e e+:
Wildebeest- + In+ → NU-E
To je teoretična podlaga za številne organske reakcije, kot je aromatična elektrofilna substitucija. Nukleofil ni nujno, da je anion, ampak je lahko tudi nevtralna molekula z elektronegativnim atomom, kot je dušik.
Vam lahko služi: silicij: zgodovina, lastnosti, struktura, pridobivanje, uporabePrimeri elektrofilcev
Lewisove kisline
Lewisove kisline so elektrofili, ker po definiciji sprejemajo elektronske pare. Kovinski kationi, mn+, Privabite negativna območja okoliških polarnih molekul v solvacijskih procesih. Tako, mn+ konča okoli negativnih obremenitev, celo sprejema elektrone, da oblikujejo koordinacijske komplekse.
Cucion cu2+, Na primer, gre za Lewisovo kislino in elektrofil, ker je usklajen z atomi vodnih kisika, da tvori kompleksni ACU2)62+. Na enak način se zgodi z drugimi kationi.
Niso vse Lewisove kisline kationi: nekatere so nevtralne molekule ali atomi. Na primer bf3 To je Lewisova kislina in elektrofil, ker.
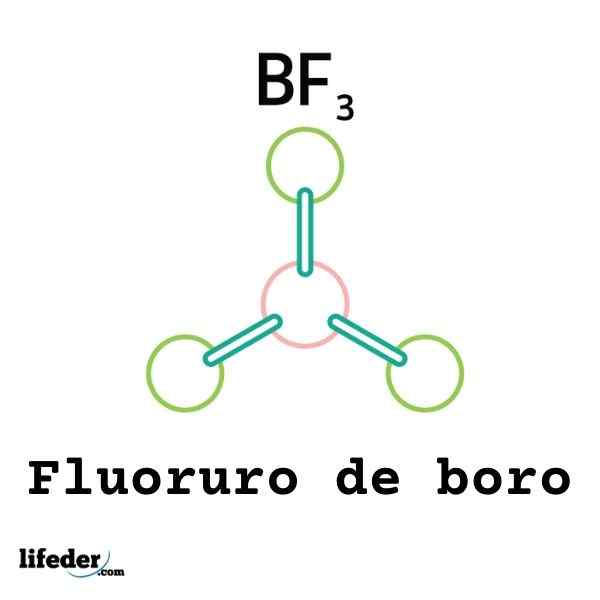
Tako bo povezan z okoliškim fluoridnim anionom, da tvori boro tetrafluoruro anion, bf4-. To je bf3 tvori povezavo s f- s sprejetjem nekaj njihovih elektronov.
Druga elektrofija je nitronio ion, ne2+, ki je a Elektrofilno sredstvo zelo močno oblikovano v reakcijah nitracije benzena. V tem ionu ima dušikov atom pozitivno obremenitev, zato benzenski elektroni hitro sprejmejo.
Brönsted kisline
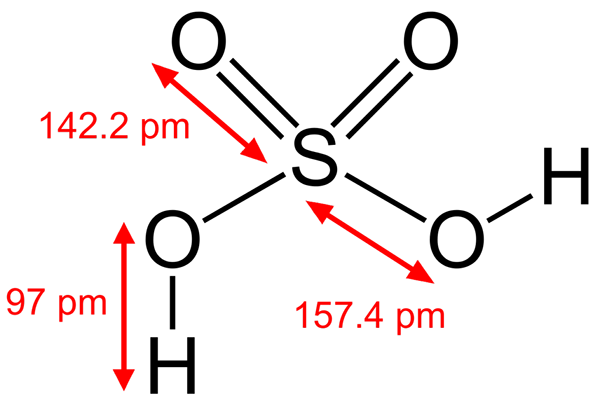 Struktura žveplove kisline
Struktura žveplove kisline Nekatere kisline Brönsted so tudi elektrofili. Na primer hidronijeva kation, h3Tudi+, Je elektrofil, ker ima atom kisika pozitivno obremenitev. Ker ste zelo elektronegativni, boste želeli pridobiti elektrone, ki bodo darovali enega od njegovih vodikov, da se preoblikujejo v molekulo vode.
Še ena Brönsted kislina, kot je žveplova kislina, h2SW4, Je tudi elektrofil. Atom žvepla je zelo oksidiran in si bo prizadeval pridobiti elektrona, ki darovata svoja dva vodika.
Vam lahko služi: ogljikov tetraklorid (CCL4)Halogeni
Halogeni (f2, Cl2, Br2 in jaz2) So elektrofili. Njeni atomi nimajo elektronskih pomanjkljivosti; Vendar so njihove povezave nestabilne, saj oba atoma, X-X, zelo močno pritegneta elektrone vanje.
Zato halogeni reagirajo kot oksidacijska sredstva, ki se obnašajo kot elektrofili in sprejemajo elektronske pare, da postanejo halogenidni anioni (F-, Cl-, Br- in jaz-).
Vendar halogeni na ta način ne samo osvojijo elektrone. Prav tako so lahko povezani z manj elektronegativnimi atomi kot oni, da dobijo neto elektron. Na primer, to je razlog, zakaj jih je mogoče dodati dvojnim vezam alkenov ali olefinov.
Halogeni predstavljajo drugačno vrsto elektrofije za dva, ki sta bila predstavljena na začetku. Vendar je njegovo vedenje na koncu enako kot za vse elektrofilce: sprejmite elektronske pare.
Halonidi za najem in vodik
 CFC molekule so alkilne halogenide
CFC molekule so alkilne halogenide Najemni in vodikovi halogenidi so elektrofili, v katerih ima atom, povezan s halogenom, močno elektronsko pomanjkanje, ki ga predstavlja simbol δ+. To je zato, ker halogen, zelo elektronegativen, privabi elektronsko gostoto sosednjega atoma sebi.
Za alkilne halogenide, RX, R bo imel elektronsko pomanjkanje, medtem ko X presežni elektroni, rδ+-Xδ-. Če se tako zelo negativna vrsta približa RX.
Tudi v vodikovih halogenih, HX, vodik ima elektronsko pomanjkanje ali pozitivno delno obremenitev, hδ+-Xδ-. Zato bodo negativne vrste prinesle svoje elektrone v ta vodik in on jih bo kot elektrofil sprejel.
Karbonilne spojine
Kisline, halogeni in halogenidi niso edine molekule, ki jih je mogoče razvrstiti kot elektrofilce. Tudi če ne, ogljikov dioksid, co2, Gre za elektrofil, ker je centralni atom ogljika zelo oksidiran, OR = Cδ+= O.
Vam lahko postreže: Flask Flat BackgroundTorej, ko so -2 Reacta bo to storila s sprejemanjem elektronskih parov, bodisi postala karboksilat, COOH Group ali karbonatni anion, CO32-.
Poleg Co2, Karbonilne spojine, kot so ketoni, aldehidi in estri, so tudi primeri elektrofilcev, saj ima v njih ogljik pozitivno delno obremenitev in sprejema elektrone zelo negativnih vrst.
Karbokacije
 Atom ogljika metana pozitivno naložen
Atom ogljika metana pozitivno naložen Karbokacije so izjemno močne Lewisove kisline. Obstajajo terciarni (r3C+), sekundarno (r2Hc+) ali primarno (rh2C+). Carbon vedno tvori štiri vezi, zato bo ta kation na kakršen koli način iskal, kako sprejeti elektrone.
Elektrofilnost
Niso vsi elektrofili prav tako "lačni" elektroni. Nekateri so bolj reaktivni kot drugi. Večja kot je pomanjkanje elektronskega elektrofila, večja je občutljivost za trpljenje nukleofilnih napadov negativnih vrst. To pomeni, da bo predstavljala večjo elektrofilnost, kar je relativno merilo, kako reaktiven je zadevni elektrofil.
Na primer, karbokacije, nitronium in fluorid imajo visoko elektrofilalnost; Medtem ko imajo ogljikov dioksid ali nekateri kationi, kot je natrij.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). Elektrofil. Pridobljeno iz: v.Wikipedija.org
- James Ashenhurst. (2020). Nukleofili in elektrofili. Okrevano od: mastersorganicChemistry.com
- Profesor Patricia Shaley. (2012). Nukleofili in elektrofili. Univerza v Illinoisu. Okreval od: butana.Kem.Uiuc.Edu
- Danielle Reid. (2020). Elektrofil: definicija in primer. Študij. Okrevano od: študij.com
- Tim Soderberg. (7. oktober 2019). Elektrofili. Kemija librettexts. Okrevano od: kem.Librettexts.org
- « BIOT-SAVART LAZNI FORMURA, PREDSTAVITEV
- Shelfordov zakon o toleranci, kaj je sestavljeno, in primeri »

