Struktura klora dioksida (CLO2), uporaba, pridobivanje, tveganja, lastnosti

- 4441
- 835
- Percy Feeney
On Klorin dioksid Gre. Njegova kemična formula je CLO2. Je zelenkasto do rdečkasto rumeni plin. Seveda ga ne najdemo v okolju.
Je izjemno reaktiven, zato je običajno, da se pripravi na mestu, kjer se bo uporabljal. Ena najpomembnejših načinov je mikrobicid, antiseptik in deodorizacija, ker zelo enostavno in v zelo nizkih koncentracijah odpravlja bakterije, viruse in glive.
 Nekatera živila, prodana v supermarketih2. Avtor: ElasticComputFarm. Vir: Pixabay.
Nekatera živila, prodana v supermarketih2. Avtor: ElasticComputFarm. Vir: Pixabay. Omogoča razkuževanje hrane, kot so zelenjava, sadje, meso, ptice in morski sadeži. Služi za higienizacijo površin, tal, kopalnic, prezračevalnih sistemov, bazenov, laboratorijske opreme, zobozdravstvene opreme itd.
Zato se uporablja pri predelavi hrane, v bolnišnicah in klinikah, v panogah in trgovinah. Uporablja se za čiščenje vode, ki se uporablja za pijačo, in tudi komunalno odpadno vodo.
Zelo učinkovit je kot oksidacijsko sredstvo, zato se uporablja za beljenje papirnate kaše, olja, moke, usnja, tekstilnih vlaken.
Ko je v obliki plina, je zelo nevaren, saj je zelo eksploziven in se uporablja predvsem v vodnih raztopinah. Je strupeno, če vdihava.
[TOC]
Struktura
Klor dioksid tvori združitev klora (CL) z dvema atoma kisika (O). Povezave s klorom z vsakim kisikom so kovalentne in dvojne. Klor v tej spojini ima valenco +4.
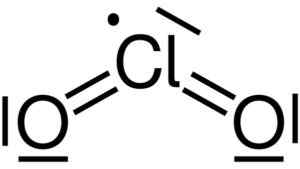 Lewisova struktura klora dioksida2. Yikrazuul [javna domena]. Vir: Wikimedia Commons.
Lewisova struktura klora dioksida2. Yikrazuul [javna domena]. Vir: Wikimedia Commons. Ima simetrično in kotno oblikovano strukturo, ker ima proste elektrone. To pomeni, da ne tvorijo povezave z nobenim drugim atomom.
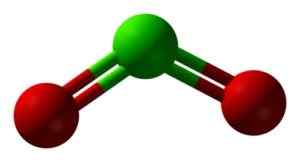 CLO STRUKTURA2 v treh dimenzijah. Zelena = klor; Rdeča = kisik. Ben Mills in Jynto [Public Domain]. Vir: Wikimedia Commons.
CLO STRUKTURA2 v treh dimenzijah. Zelena = klor; Rdeča = kisik. Ben Mills in Jynto [Public Domain]. Vir: Wikimedia Commons. Nomenklatura
- Klorin dioksid
- Klorin oksid (IV)
Lastnosti
Fizično stanje
Zelenkasto rumena do rdečkasto rumeni plin.
Molekularna teža
67,45 g/mol.
Tališče
-59 ° C.
Vrelišče
11 ° C.
Gostota
Tekočina pri 0 ° C = 1.642 g/cm3
Plin = 2,33 (relativna gostota zraka, zrak = 1).
Lahko vam služi: izoamilni alkohol: struktura, lastnosti, uporabe in tveganjaTopnost
Voda topna: 2000 cm3 CLO2 plin pri 100 cm3 hladne vode ali 0,8 g/100 ml vode pri 20 ° C. Topno v alkalni raztopini in v raztopini žveplove kisline H2SW4.
Kemične lastnosti
CLO2 Je izjemno reaktiven in lahko silovito izkorišča. Je zelo učinkovito oksidacijsko sredstvo.
CLO2 Silovito se zlomi, če pride v stik z organskimi materiali. Če ste v zraku pri koncentraciji, večji od 10%, lahko eksplodira zaradi sončne svetlobe ali toplote.
Prav tako lahko eksplodirate v prisotnosti živega srebra (HG) ali ogljikovega monoksida (CO).
Pod delovanjem ultravijoličnega (UV) ali ozona CLO2 Postane klor heksoksid2Tudi6, zelo nestabilna spojina.
Lastnosti vaših vodnih raztopin
Njegove vodne raztopine so rumene ali rdečkasto rumene. So stabilni, če ostanejo hladni, dobro zaprti in zaščiteni pred sončno svetlobo. V prisotnosti svetlobe se te raztopine počasi razgradijo, da dajo HCl klorovodikovo kislino in HClo klorovodikovo kislino3.
 Vodna raztopina CLO2 Kjer opazimo, da se sprošča rumeni plin, ki je CLO2. Avtor: MaterialScientist. Vir: Wikimedia Commons.
Vodna raztopina CLO2 Kjer opazimo, da se sprošča rumeni plin, ki je CLO2. Avtor: MaterialScientist. Vir: Wikimedia Commons. V alkalnih rešitvah CLO2 Razčlenjen je na ionske kloritne clo2- in klorat3-. V kislinskih raztopinah tvori kloro kislina hclo2 In potem je to razčlenjeno na HCl klorovodikovo kislino in HClO klorovodikovo kislino3.
Druge lastnosti
Koncentrirane hlape CLO2 So potencialno eksplozivni, zato ni bilo mogoče stisniti niti le z drugimi plini. Zaradi tega je raje pripraviti na mestu, kjer se bo uporabljal.
Kadar je v svoji hidrirani obliki zelo nizke temperature, kar je tako, kot se včasih prenaša, je trdna v obliki ledu in oranžne barve.
Ima vonj, podoben kloru. Je strupena z vdihavanjem.
Pridobivanje
Lahko dobimo na več načinov. Na primer, v nekaterih primerih rešitve CLO2 Pripravijo se, da prenesejo mešanico klora (CL2) in zrak (ali klora in dušikovega plina2) skozi stolpec, ki vsebuje zrnca natrijevega klorita (NaClo2).
Vam lahko služi: plast Valencia2 NaClo2 + Cl2 → 2 NaCl + 2 CLO2
Ustvarjeni izdelek vsebuje približno 90% CLO2, Med drugimi kloroškimi spojinami.
Dobimo ga tudi iz kalijevega klorata (kclo3) in žveplova kislina (h2SW4) V prisotnosti oksalne kisline kot reduktor. V tem primeru se oblikuje tudi ogljikov dioksid (CO2), ki služi za redčenje CLO2.
Pripravite ga lahko na spletnem mestu uporabe na podlagi natrijevega klorata (NACLO3), žveplova kislina (h2SW4) in metanol (izberite3OH).
V industriji ga dobimo z natrijevim kloratom (NACLO3) in žveplov dioksid (tako2) V prisotnosti žveplove kisline.
2 NaClo3 + SW2 + H2SW4 → 2 CLO2 + 2 NaHSO4
Uporablja kot razkužilo
Uporablja se lahko kot močno protimikrobno sredstvo. Ugotovljeno je bilo, da je zelo učinkovit proti več mikroorganizmi, kot je Escherichia coli in zlati stafilokok.
S slednjim koncentracijo samo 5 ppm CLO2 odpraviti 100%. Je baktericidna, antiseptična in deodorizirajoča. Je učinkovit v širokem pH intervalu.
V hrani
Uporablja se kot protimikrobno sredstvo v vodi za sadje in zelenjavo, pri predelavi ptic, rdečega mesa, tako koščkov mesa kot organov ter morskih izdelkov ter morskih sadežih.
 Rdeče meso supermarketov je bilo morda obdelano s klorovim dioksidom, da bi jih razkužili. Avtor: Karamo. Vir: Pixabay.
Rdeče meso supermarketov je bilo morda obdelano s klorovim dioksidom, da bi jih razkužili. Avtor: Karamo. Vir: Pixabay. V koncentraciji je treba uporabiti raztopine klora dioksida, ki ne presega 3 ppm (stranke na milijon) CLO2 preostali, tako da ne vpliva na hrano.
Po zdravljenju s CLO2 Vsa živila je treba v celoti vladati s pitno vodo ali pa jo je treba uporabljati kot luščeno, kuhanje ali konzerviranje.
V primeru morskih izdelkov je kanalizacijska rešitev2 Uporabiti ga je treba v vodi in ledu, ki se uporabljajo pri izpiranju, pranju, odmrzovanju, prevozu ali skladiščenju. Surove morske hrane je treba pred uživanjem zelo dobro oprati s pitno vodo.
 Hladna voda in led, s katerimi morski sadje vsebuje majhne količine CLO2. Avtor: javne domene. Vir: Pixabay.
Hladna voda in led, s katerimi morski sadje vsebuje majhne količine CLO2. Avtor: javne domene. Vir: Pixabay. Na papir in karton, ki bo prišel v stik s hrano
CLO REŠITVE2 Uporabljajo se za odpravljanje mikroorganizmov, ki povzročajo vitke (na primer alge, bakterije in glive) v procesni vodi, ki se uporablja pri izdelavi papirja in kartona, ki bodo prišli v stik s hrano.
Vam lahko služi: apolarne molekuleV pitni vodi
Služi za čiščenje vode in jo pijejo (varno za pijačo). Uporablja se pri predobdelavi z vodo, ki bo nato ustekleničena za pijačo ali vodo, ki bo uporabljena kot sestavina pri izdelavi pijač ali brezalkoholnih pijač.
 Nekatere predelane brezalkoholne pijače lahko vsebujejo obdelano vodo s CLO2. Susan Slater [CC BY-SA (https: // createCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Nekatere predelane brezalkoholne pijače lahko vsebujejo obdelano vodo s CLO2. Susan Slater [CC BY-SA (https: // createCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. V zobozdravstvu
Uporablja se v instrumentih, ki jih zobozdravnik ali zobozdravnik uporablja za razkuževanje in uničenje patogenskih organizmov v njih.
V medicinskih aplikacijah
Vodne rešitve CLO2 Uporabljali so se za zdravljenje ustne kandidiaze (okužba ust). Kandidiaza je okužba z glivico Candida albicans.
 Nastop gliv Candida albicans v laboratorijskem pridelku. CDC/DR. William Kaplan [javna domena]. Vir: Wikimedia Commons.
Nastop gliv Candida albicans v laboratorijskem pridelku. CDC/DR. William Kaplan [javna domena]. Vir: Wikimedia Commons. Klorin dioksid odpravlja usta iz ust in znatno izboljša videz ustnih tkiv brez stranskih učinkov.
Nekateri medicinski raziskovalci kažejo, da so rešitve CLO2 Uporabljajo se za rane kirurških operacij, lahko zmanjšajo ali zavirajo nastanek pristopov, ne da bi to vplivale na ozdravitev istega, z dodatno prednostjo njenih antiseptičnih lastnosti.
Druge uporabe
Za svoje oksidacijske in mikrobicidne lastnosti CLO2 se uporablja za:
- Beli celulozo lesa v proizvodnji celuloze in papirja, kar zagotavlja stabilen sijaj.
- Okrasite maščobe in olja, usnje, belo moko in tekstil.
- Kmetijske aplikacije, kot so razkuževanje trdih površin, opreme, vodnih sistemov in gobjih rastlinjakov.
- Aplikacije v panogah, trgovinah in bolnišnicah, kot so razkuževanje trdih površin (stene, tla, kopalnice), prezračevalni sistemi, laboratorijska oprema.
- Razkužene stanovanja in kopalnice gospodinjstev, klimatske naprave, sistemi za plavanje vode.
- Obdelava komunalne in industrijske odpadne vode.
- Čiščenje onesnaževanja naftnih polj.
- Proizvodnja kloridnih soli (CL-).
Tveganja
- Koncentrirane hlape CLO2 So potencialno eksplozivni.
- Je strupen z vdihavanjem in zaužitjem. To je razdražljivo oko, nos in grlo, lahko povzroči pljučni edem in kronični bronhitis.
- Po navedbah virov, ki so se posvetovali s CLO2 ne povzroča mutacij DNK ali povzroča raka pri ljudeh.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Klorin dioksid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Dean, J.Do. (urednik). (1973). Langeov priročnik kemije (enajsta izdaja). McGraw-Hill Book Company.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. VCH Verlagsgellschaft MBH.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Bajpai, str. (2012). Bleranje klora dioksida. Vpliv beljenja klora dioksida na kakovost celuloze. V okolju benignih pristopih za beljenje celuloze (druga izdaja). Okrevano od Scientirect.com.
- Moran, s. (2018). Kemija vode. Klorin dioksid. V nanosenem vodniku za oblikovanje čistilne naprave za vodo in odpadkov. Okrevano od Scientirect.com.
- McKen, l. (2012). Uvod v prehrano in medicinsko sterilizacijo. Odmeven zborovski dieksid. V učinek sterilizacije na plastiko in elastomere (tretja izdaja). Okrevano od Scientirect.com.
- « Zgornje paleolitske značilnosti, umetnost, družbena organizacija
- Struktura sulfonske kisline, nomenklatura, lastnosti, uporablja »

