Struktura ogljikovega disulfida (CS2), lastnosti, uporabe, tveganja
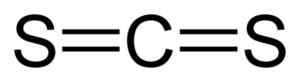
- 3935
- 930
- Don Nitzsche
On ogljikov disulfid Gre za spojino, ki jo tvori združitev ogljikovega atoma (c) in dveh atomov žvepla. Njegova kemična formula je CS2. Je brezbarvna ali rahlo rumena tekočina z neprijetnim vonjem zaradi nečistoč, ki jih vsebuje (žveplove spojine). Ko je čist njegov vonj mehak in sladek, podoben kloroformu ali etru.
Seveda izvira iz delovanja sončne svetlobe na organskih molekulah, ki jih najdemo v morski vodi. Poleg tega se pojavlja v močvirnih vodah in je izgnan tudi iz vulkanov skupaj z drugimi plini.
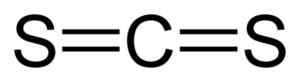 CS ogljikov disulfid2. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
CS ogljikov disulfid2. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Ogljikov disulfid je hlapna tekočina in je tudi zelo vnetljiva, zato ga je treba držati stran od plamena in iskre ali naprav, ki jih lahko proizvajajo, vključno z električnimi žarnicami.
Ima sposobnost raztapljanja velikega števila spojin, materialov in elementov, kot so fosfor, žveplo, selen, smole, laki itd. Zato se zdi uporabnost kot topilo.
Prav tako je posrednik v različnih industrijskih kemičnih reakcijah, kot sta proizvodnja rajona ali umetna svila.
Manipulira ga previdno in z zaščitnimi pripomočki, ker je zelo strupen in nevaren.
[TOC]
Struktura
Ogljikov disulfid ima ogljikov atom in dva atoma žvepla na straneh tega.
Povezave med ogljikovim atomom in atomi žvepla so kovalentne in dvojne, zato so zelo močne. Molekula CS2 Ima linearno in simetrično strukturo.
 Linearna struktura ogljikovega disulfida CS2. Črna = ogljik, rumena = žveplo. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
Linearna struktura ogljikovega disulfida CS2. Črna = ogljik, rumena = žveplo. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Nomenklatura
- Ogljikov disulfid
- Ogljikov bisulfid
- Ditiokarbon anhidrid
Lastnosti
Fizično stanje
Brezbarven do rumenkast.
Molekularna teža
76,15 g/mol
Točka fuzije ali strjevanja
-110,8 ° C
Vrelišče
46,0 ° C
Plamenišče
-30 ° C (metoda zaprte skodelice).
Temperatura samostojnosti
90 ° C
Gostota
Tekočina = 1,26 g/cm3 pri 20 ° C.
Steam = 2,67 -krat večji zrak.
Njeni hlapi so več kot dvojni težki od zraka in tekočina je težja od vode.
Parni tlak
279 mmHg pri 25 ° C.
Vam lahko služi: kalijev hipoklorit (kclo)To je visok tlak s paro.
Topnost
Zelo malo topne vode: 2,16 g/l a 25 ° C. Topno v kloroformu. Mešljiv z etanolom, metanolom, etrom, benzenom, kloroformom in ogljikovim tetrakloridom.
Kemične lastnosti
Cs2 Z lahkoto izhlapi pri sobni temperaturi, ker je njegova vrelišče zelo nizka, njen tlak pare pa zelo visok.
Ogljikov disulfid je izjemno vnetljiv. Njegovi hlapi so zelo enostavno vnesti, tudi s toploto električne žarnice. To pomeni, da zelo hitro reagira s kisikom:
Cs2 + 3 o2 → co2 + 2 Torej2
Dejstvo, da imate pri sobni temperaturi visok parni tlak, je nevarno biti blizu plamena.
Kadar se ogreva na razgradnje zlahka izkorišča, oddaja strupene pline iz žveplovih oksidov. Nad 90 ° C se vklopi spontano.
Se pokvari, ko ga dolgo shrani. Napadite baker in njegove zlitine. Reagira tudi z nekaj plastike, gumarjev in premazov.
Reagira v določenih pogojih z vodo, ki tvori OCS karbonil sulfid, premog dioksid Co2 in vodikov disulfid h2S:
Cs2 + H2O → ocs + h2S
Cs2 + 2 h2O → co2 + 2 h2S
Z alkoholi (ROH) v alkalnem mediju tvori ksantate (RO-CS-NNA):
Cs2 + ROH + NaOH → H2Ali + ro -c (= s) -Sna
Pridobivanje
Ogljikov disulfid se komercialno pripravlja z žveplovo reakcijo s premog. Postopek se izvaja pri temperaturah 750-900 ° C.
C + 2 S → CS2
Namesto premoga lahko uporabite tudi metan ali zemeljski plin, uporabljeni so bili celo etan, propan in propilen, v tem primeru se reakcija pojavi pri 400-700 ° C z visoko zmogljivostjo.
Pripravimo ga lahko tudi z reakcijo zemeljskega plina z vodikovim sulfidom H2Je zelo visoka temperatura.
Prisotnost v naravi
Cs2 To je naravni izdelek, ki je prisoten v atmosferi v zelo majhnih količinah (sledi). Pojavi se fotokemično v površinskih vodah.
Delovanje sončne svetlobe na določenih spojinah, ki so prisotne v morski vodi, kot je cistein (aminokislina), vodi v tvorbo ogljikovega disulfida.
 Ogljikov disulfid se lahko tvori z delovanjem sončnih žarkov na nekaterih organskih spojinah, ki so prisotne v morski vodi. Avtor: Pexels. Vir: Pixabay.
Ogljikov disulfid se lahko tvori z delovanjem sončnih žarkov na nekaterih organskih spojinah, ki so prisotne v morski vodi. Avtor: Pexels. Vir: Pixabay. Seveda se sprošča tudi med vulkanskimi izbruhi in ga najdemo v majhnih količinah nad močvirji.
Vam lahko služi: benzaldehidObičajno smo izpostavljeni dihanju v zelo majhnih deležih in smo prisotni v nekaterih živilih. Najdemo ga tudi v dimu cigaret.
V okolju se razpade skozi sončno svetlobo. Na tleh se premika skozi njega. Nekateri mikroorganizmi v tleh se razgradijo.
Prijave
V kemični industriji
Ogljikov disulfid je pomembna kemična spojina, saj služi za pripravo drugih kemikalij. Lahko deluje kot kemični posrednik.
Uporablja se tudi kot procesno topilo za raztapljanje fosforja, žvepla, selena, broma, joda, maščob, smol, voskov, lakov in gumenjakov.
Med drugim omogoča proizvodnjo farmacevtskih izdelkov in herbicidov.
V proizvodnji Rayóna in Celofána
S cs2 Pripravljeni so Xantatos, ki so spojine, ki se uporabljajo pri proizvodnji Rayóna in Celofána.
Za pridobitev umetne svile ali rajona temelji na celulozi, ki jo zdravimo z alkalijsko in ogljikovo disulfidno CS2 in se pretvori v celulozni ksantat, topno v alkaliji. Ta rešitev je viskozna in se zato imenuje "Viscosa".
Viskoza je narejena pod pritiskom skozi zelo majhne luknje znotraj kisle kopeli. Tu se celulozni ksantat ponovno spremeni v celulozo, ki je netopna in dolga in svetla nit nastajajo.
Niti ali nitke se lahko zavrtijo, da dajo gradivo, znano kot Rayón.
(1) Celuloza + NaOH → Alkalije-celuloza
ROH + NaOH → Rona
(2) Alkalno-celuloza + ogljikov disulfid → celuloza xantat
Rona + s = c = s → ro -c (= s) -Sna
(3) ksantat celuloze + kisline → celuloza (nitke)
Ro -c (= s) -Sna + kislina → roh
 Oblačila, narejena z rajonom, vlakninami, katerih proizvodnja sodeluje z ogljikovim disulfidom. Tobias "Take" Maier [CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Oblačila, narejena z rajonom, vlakninami, katerih proizvodnja sodeluje z ogljikovim disulfidom. Tobias "Take" Maier [CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Če celulozo oborimo tako. To se zmehča z glicerolom in se uporablja kot zaščitni film predmeta.
 Celofan je izdelan s pomočjo ogljikovega disulfida. Avtor: Hans Braxmeier. Vir: Pixabay.
Celofan je izdelan s pomočjo ogljikovega disulfida. Avtor: Hans Braxmeier. Vir: Pixabay. V proizvodnji ogljikovega tetraklorida
Ogljikov disulfid reagira s klorovim CL2 Dati ogljikov tetraklorid CCL4, kar je pomembno topilo, ki ni gorivo.
Vam lahko služi: klorobenzen (C6H5Cl)Cs2 + 3 Cl2 → CCl4 + S2Cl2
V več aplikacijah
Ogljikov disulfid sodeluje pri hladni vulkanizaciji gume.
Xantatos, pripravljen s cs2 Uporabljajo se v mineralni flotaciji.
Stara uporaba
Cs2 To je strup za žive organizme. Prej so ga uporabljali za uničenje škodljivcev, kot so podgane, marmote in mravlje, ki je v vsakem zaprtem prostoru, v katerem so živele te živali.
Ko so v ta namen uporabili goste strupene hlape, so končali vsak živi organizem, ki je bil v zaprtem prostoru.
Uporabljali so ga tudi kot antihelmintik za živali in za odstranjevanje ličink iz Moscardonov iz želodca konj.
V kmetijstvu so ga uporabljali kot insekticid in nematicid, za fumigacijo tal, za odpiranje vrtcev, skednja, silosov in žitnih mlinov. Prav tako so bili zamrznjeni železniški avtomobili, ladje in barke.
 Kmet leta 1904 je z ogljikovim disulfidom zajebal tla za boj proti kugi grozdnih rastlin. Ölgemälde von hans pühringer, 1904 [gfdl 1.2 (http: // www.GNU.Org/licence/stare licence/fdl-1.2.html)]. Vir: Wikimedia Commons.
Kmet leta 1904 je z ogljikovim disulfidom zajebal tla za boj proti kugi grozdnih rastlin. Ölgemälde von hans pühringer, 1904 [gfdl 1.2 (http: // www.GNU.Org/licence/stare licence/fdl-1.2.html)]. Vir: Wikimedia Commons. Vse te uporabe so bile prepovedane zaradi visoke vnetljivosti in toksičnosti CS2.
Tveganja
Cs2 Je zelo vnetljivo. Veliko vaših reakcij lahko povzroči požar ali eksplozijo. Mešanice njihovih hlapov z zrakom so eksplozivne. Pri vnetju proizvajajo dražilne ali strupene pline.
Ogljikovega disulfida za odtoke ne smete vlivati, ker v cevi je mešanica CS2 in zrak, ki lahko povzroči eksplozijo, če je prižgana po naključju.
Njegovi hlapi spontano streljajo v stik z iskri ali vročimi površinami.
Ogljikov disulfid močno draži oči, kožo in sluznico.
Če centralni živčni sistem vdihnemo ali zaužijemo resno, kardiovaskularni sistem, oči, ledvice in jetra. Prav tako se lahko absorbira skozi kožo, kar povzroči poškodbe.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2020). Ogljik disulfida. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Mopper, k. In Kieber, D.J. (2002). Fotokemija in kolesarjenje z ogljikom, žveplom, dušikom in Posferi. V biogeokemičnost morske raztopljene organske snovi. Okrevano od Scientirect.com.
- Meyer, b. (1977). Industrijska uporaba žvepla in njegovih pripomočkov. Ogljik disulfida. V žveplom, energiji in zaviranju. Okrevano od Scientirect.com.
- Pohanish, r.Str. (2012). C. Ogljik disulfida. V SITTIG -ovem priročniku strupenih in nevarnih kemikalij in rakotvornih snovi (šesta izdaja). Okrevano od Scientirect.com.
- Morrison, r.T. in Boyd, r.N. (2002). Organska kemija. 6. izdaja. Prentice-Hall.
- Windholz, m. et al. (uredniki) (1983). Indeks Merck. Enklopedija kemikalij, zdravil in bioloških. Deseta izdaja. Merck & co., Inc.
- « 95 najboljših stavkov katoliških svetnikov
- +105 katoliških stavkov o veri, razmišljanju, molitvi in upanju »

