Dimetilamin ((CH3) 2NH) struktura, lastnosti, uporabe, tveganja
- 4964
- 1239
- Miguel Gutmann DVM
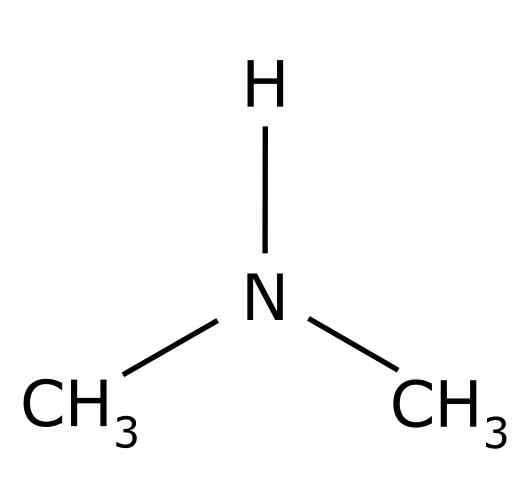
The dimetilamin Gre za organsko spojino, ki jo tvorita dve metilni skupini -CH3 Združen v skupino -nh. Njegova kemična formula je (CHO3)2Nh. To je brezbarven plin. Ko se v zraku dojema vonj po ribah pri nizkih koncentracijah. Če pa je v visoki koncentraciji, ima vonj po amoniaku NH3.
Dimetilamin je prisoten v rastlinah in živalih. Verjame se, da v človeku izhaja iz razpadanja nekaterih encimov, pa tudi iz zaužitja nekaterih živil, kot je riba. Če se dimetilamin plin raztopi v vodi, tvori zelo alkalne in jedke rešitve.
 Dimetilamin. Ring0 [javna domena]. Vir: Wikimedia Commons.
Dimetilamin. Ring0 [javna domena]. Vir: Wikimedia Commons. Ima različne industrijske namene, kot so za izdelavo topil, za pospešitev vulkanizacije gume.
Dimetilamin je zelo vnetljiv plin. Zabojnikov, ki jih vsebujejo, ne bi smeli biti izpostavljeni vročini ali ognju. Poleg tega so njihovi hlapi dražilne oči, kože in dihal.
To je spojina, ki je lahko del atmosferskih aerosolov, torej zelo tankih kapljic, ki jih najdemo v atmosferi.
[TOC]
Struktura
Dimetilamin je sekundarni alifatski amin. To pomeni, da so dušikovi substituenti (n) alifatski (-CH3), kar pomeni, da niso aromatični in da sta dva. Zato obstajata dva metil -ch3 Združeni dušik, ki ima tudi vodik (H).
V molekuli dimetilamina ima dušik (n) par prostih elektronov, torej nekaj elektronov, ki niso združeni z nobenim drugim atomom.
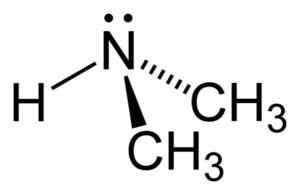 Struktura dimetilamina. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
Struktura dimetilamina. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Nomenklatura
- Dimetilamin
- N, N-dimetilamin
- N-metilmetanamin
- DMA (kratica za di-metil-amin).
Lastnosti
Fizično stanje
Brezbarven plin.
Molekularna teža
45,08 g/mol
Tališče
-93 ° C
Vrelišče
7,3 ° C
Plamenišče
-6,69 ° C (metoda zaprte skodelice).
Temperatura samostojnosti
400 ° C
Vam lahko služi: zakon več razsežnostiGostota
Tekočina = 0,6804 g/cm3 A 0 ° C.
Steam = 1,6 (relativna gostota glede na zrak, zrak = 1).
Topnost
Zelo topno v vodi: 163 g/100 g vode pri 40 ° C. Topno v etanolu in etilnem etru.
ph
Vodne raztopine dimetilamina so močno alkalne.
Konstanta disociacije
Kb = 5,4 x 10-4
Pkdo konjugirane kisline = 10,732 do 25 ° C. Konjugatna kislina je dimetilamonijev ion: (Cho3) NH2+
Kemične lastnosti
Tekoči dimetilamin lahko napade nekaj plastike, pnevmatik in premazov.
Pri raztapljanju v vodi, brez dušikovega elektrona (n), vzame proton (h+) vode, ki pusti svobodno-, Torej tvori zelo alkalne in jedke rešitve:
Dimetilamin + voda → dimetilamonijev ion + hidroksilni ion
(Pogl3)2NH + H2O → (izberite3)2Nh2+ + Oh-
Z dušikovo kislino dobimo nitratno sol, to je dimetila amotilamonijev nitrat:
Dimetilamin + dušikova kislina → dimetilamonijev nitrat
(Pogl3)2NH +HNO3 → (pogl3)2Nh2+Ne3-
Druge lastnosti
Kadar ima v nizki koncentraciji zraka, podoben ribe, medtem ko v visokih koncentracijah diši po amoniaku (NH3).
Biokemične reakcije
V organizmu lahko dimetilamin v šibko kislih pogojih trpi nitrilarno, da dimetilnitrozamin daje rakotvorsko spojino (ch3)2N-ne.
Nastajanje dimetlnitrozamina se pojavi iz dimetilamina in nitrita (natrijevega nitrita) v želodcu (A pH 5-6) z delovanjem bakterij, ki obstajajo v prebavilih, ki obstajajo. Natrijev nitrit je prisoten v nekaterih živilih.
Dimetilamin + natrijev nitrit → dimetilnitrozamin + natrijev hidroksid
(Pogl3)2NH + nano2 → (pogl3)2N-ne + Naoh
Pridobivanje
Dimetilamin se komercialno pripravlja tako, da reagira metanol (izberite3Oh) z amonijakom (NH3) pri 350-450 ° C v prisotnosti katalizatorja silika-alumine (SIO2/Do2Tudi3).
2 pogl3OH + NH3 → (pogl3)2NH + 2 h2Tudi
Ker se proizvajata tudi monometilamin in trimetilamin, se v seriji štirih do petih destilacijskih stolpcev izvede čiščenje.
Prisotnost v naravi
Dimetilamin najdemo v rastlinah in živalih. Prisoten je tudi naravno in obilno v človeškem urinu.
Lahko vam služi: epoksid: nomenklatura, pridobivanje, aplikacije, primeriOcenjujejo, da je njegova prisotnost pri ljudeh posledica dejstva, da se nekatere vrste črevesnih bakterij proizvajajo iz nekaterih spojin, ki jih najdemo v hrani.
Nekatere od teh spojin so hrib (spojina, ki je povezana z vitaminovo skupino B) in trimetilaminskim oksidom. Prav tako se verjame, da izvira iz encimskega zaviralca dušikovega oksida (NO), ki nastane v telesu.
Nekateri viri informacij kažejo, da povečanje dimetilamina v urinu povzroča zaužitje rib in sadja morja, kjer se pridobijo glavne vrednosti, ko jedo lignje, hake, sardine, meča, trske, ribe in linije.
 Uživanje rib lahko poveča raven dimetilamina v urinu. Avtorica: Anna Sulencha. Vir: Pixabay.
Uživanje rib lahko poveča raven dimetilamina v urinu. Avtorica: Anna Sulencha. Vir: Pixabay. Bolniki s presežkom dimetilamina
Šteje se, da je dimetilamin uremični toksin, to je snov, ki lahko povzroči škodo, če se njegova koncentracija v urinu dvigne. Pravzaprav so pri bolnikih z ledvično boleznijo v končni stopnji opazili zelo visoke ravni dimetilamina.
Verjame se, da pri teh bolnikih lahko pride do prenaseljenosti črevesnih bakterij, ki bi jih lahko proizvedli.
Prijave
DMA ali DMA se uporablja za:
- Priprava drugih spojin.
- Proizvodnja topil dimetilformamida in dimetilacetamida.
- Pospešite vulkanizacijo nekaterih dlesni.
- Odpravite dlake med porjavitvijo.
- Delujejo kot antioksidant za topila.
- Služi kot sredstvo za mineralno flotacijo.
- Zavirajo korozijo in kot anti -sniff sredstvo.
- Funkcija kot površinsko aktivno sredstvo.
- Naredite mila in detergente.
- Delujejo kot kemik v tekstilu.
- Funkcija kot protividno sredstvo v gorivih in kot stabilizator plina.
- Pripravite barvila.
- Absorbirajo kisline pline.
- Služijo kot pesticidi in rakete.
- Biti del povzročiteljev za čiščenje vode.
- Delujejo kot fungicid v agrokemičnih izdelkih.
- Že prekinjena uporabe, kot so privabljanje in iztrebljanje gorgjos ali žuželk, ki napadajo bombaž.
 Rastlina bombaža. Avtor: Isaa KC. Vir: Pixabay.
Rastlina bombaža. Avtor: Isaa KC. Vir: Pixabay.  V preteklosti so bile žuželke, ki napadajo bombažne rastline, izločene z dimetilaminom. Marvinbikolano [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
V preteklosti so bile žuželke, ki napadajo bombažne rastline, izločene z dimetilaminom. Marvinbikolano [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Tveganja
Dimetilaminske hlape so dražilne kože, oči in dihalnih trakta.
Vam lahko služi: anorganske spojineČe stopite v stik s kožo v tekoči obliki. Njegovo vdihavanje ima škodljive učinke na zdravje.
DMA plin je jedran in lahko tvori jedko vodne raztopine. Vaše vodne raztopine lahko postanejo vnetljive, razen če so precej razredčene.
Dimetilamin v obliki plina se zlahka vnese s proizvodnjo strupenih hlapov dušikovih oksidov (nex).
Če je posoda, ki vsebuje ta plin, izpostavljena močni vročini ali vročini, lahko eksplodira.
Vpliv DMA v atmosferi
Atmosferski aerosol (zelo majhne kapljice mešanice naravnih spojin in/ali onesnaževal v atmosferi) močno vpliva na globalno podnebje in kakovost zraka v različnih regijah sveta.
Oblikovanje novih delcev aerosola še ni popolnoma razumljeno.
Ocenjuje se, da dimetilamin sodeluje skupaj z drugimi spojinami pri tvorbi teh delcev, kar se zdi, da je odvisno od območja močnih emisij DMA.
Na primer, na industrijskih območjih je večja koncentracija kot na kmetijskih območjih, kar lahko vpliva na način sodelovanja DMA.
Treba je opozoriti, da lahko po nekaterih znanstvenikih kurjenje rastlinskega materiala, ki vsebuje glifosat (eden od herbicidov, ki se najbolj uporablja na svetu), privede do tvorbe dimetilamina.
 Atmosferski aerosoli na Južni Ameriki. Dimetilamin bi lahko prispeval k njeni tvorbi. Marvinbikolano [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Atmosferski aerosoli na Južni Ameriki. Dimetilamin bi lahko prispeval k njeni tvorbi. Marvinbikolano [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Dimetilamin. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Četrta izdaja. John Wiley & Sons.
- Morrison, r.T. in Boyd, r.N. (2002). Organska kemija. 6. izdaja. Prentice-Hall.
- Windholz, m. et al. (uredniki) (1983). Indeks Merck. Enklopedija kemikalij, zdravil in bioloških. Deseta izdaja. Merck & co., Inc.
- Abramowitz, m.K. et al. (2010). Patofiziologija uremije. Alifatski amini. Pri kronični ledvični bolezni, dializi in presaditvi (tretja izdaja). Okrevano od Scientirect.com.
- Li, h. et al. (2019). Vpliv atmosferskih pogojev na tvorbo novih delcev na osnovi novih delcev na osnovi novih delcev na osnovi žveplove kisline-dimetilamin-amonije. CHOSPHER 2019; 245: 125554. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Mackie, J.C. in Kennedy in.M. (2019). Piroliza strupenih izdelkov glifosata in pesmi. Okolje. Sci. Technol. 2019: 53 (23): 13742-13747. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.

