Dihidroksiacetonska struktura, lastnosti, pridobivanje, uporabe
- 771
- 211
- Roman Schamberger
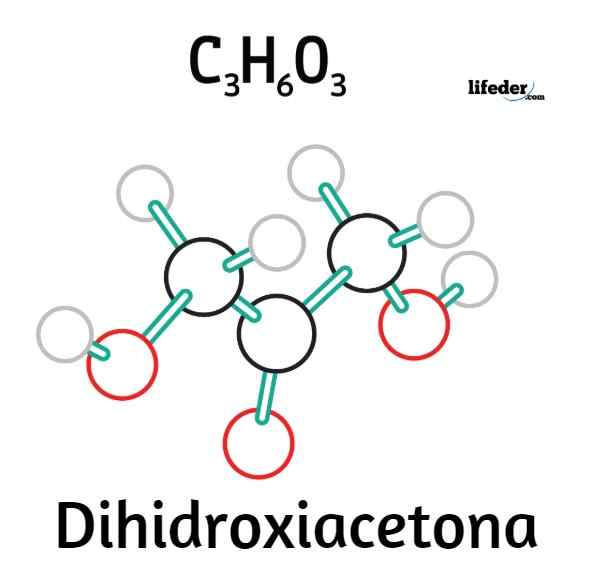
The Dihidroksiaceton Gre za saharid ali sladkor, ki je sestavljen iz najpreprostejše ketoze vseh in katerih molekularna formula je c3H6Tudi3. Zato je strukturni izomer gliceraldehida, ki ga je mogoče šteti za oksidirano različico glicerina. Njegovo ime je skrajšano s črkami DHA, tako v angleščini kot v španščini, prav tako ga poznajo z imeni 1,3-dihidroksijaceton, gliceone ali 1.3-dihidroxi-2-propanon.
Za razliko od drugih sladkorjev DHA primanjkuje asimetričnih ogljikov, zato nima konfiguracije D ali L ali predstavlja optične aktivnosti; to pomeni, da polarizirane svetlobe ne morete preusmeriti. Kaj ima skupno s sladkorji, saj je zea, je značilen sladek okus in velika topnost v vodi.
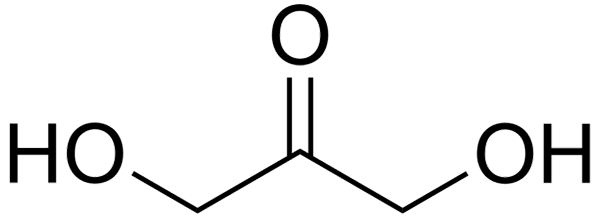 Strukturna formula dihidroksiacetona
Strukturna formula dihidroksiacetona Na vrhunski sliki imamo strukturno formulo dihidroksiacetona. Skupina C = O Central je razlog, da je DHA kettoza.
DHA lahko reagira z aminijskimi skupinami keratinov, ki sestavljajo najbolj zunanjo površino naše kože, imenovano Stratum Corneum, kar nastaja pigmente oranžnih tonov, ki na koncu dajejo videz naravnega porjavela. Zato se DHA uporablja kot aktivna sestavina v bronastih izdelkih brez sonca.
[TOC]
Struktura

Na zgornji sliki imamo strukturo molekule DHA, ki je predstavljena z modelom sfer in palic. Kot je razvidno, rdeče sfere ustrezajo atomom kisika. Njegova geometrija je skoraj ravna, saj skupine OH in H rahlo izstopajo iz ravnine, ki jo tvorijo trije ogljikovi atomi in atom karbonilnega kisika.
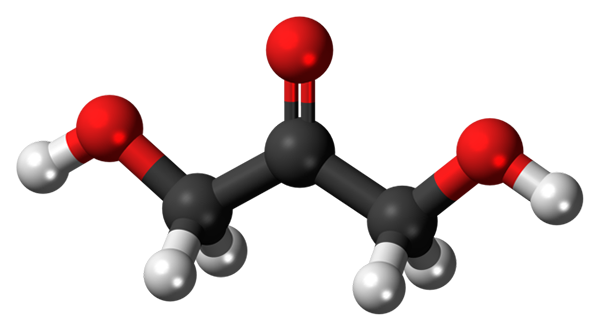 Molekularna struktura dihidroksiacetona. Vir: jynto / cc0
Molekularna struktura dihidroksiacetona. Vir: jynto / cc0 Molekula DHA je precej polarna. Skupine C = O in C-OH puščata visoko elektronsko gostoto, medtem ko je njihovo ogljikovo okostje slabi elektroni.
Vam lahko služi: acetofenonNjegove medmolekularne interakcije torej temeljijo na silih dipole-dipolo, zlasti tistih iz vodikovih mostov. Vse to prispeva k DHA kot kristalna trdna snov v normalnih pogojih.
Lastnosti dihidroksiacetona
Fizični videz
Barvita kristalna trdna, s sladkim in značilnim vonjem in okusom. Je zelo higroskopska, zato absorbira vlago okolja.
Molarna masa
90.078 g/mol
Tališče
89 do 91 ° C. Ta nenatančna vrednost je posledica dejstva, da niso vse molekule DHA v pojasnjenem stanju, ampak da jih velika večina tvori somrake.
Vrelišče
Nedoločen, saj se pokvari.
Topnost
V vodi je zelo topen, saj ima približno topnost od 930 kg/l do 25 ° C. To je posledica njegovega zelo polarnega značaja in sposobnosti vode, da jo hidrira z oblikovanjem vodikovih mostov s katerim koli od treh atomov kisika v molekuli. Vendar se počasi raztopi v mešanici vodnega stanola 1:15.
Hidroliza in raztapljanje
V trdnem stanju DHA ponavadi obstaja kot Domer. Preobrazba bi bila tista, prikazana spodaj:
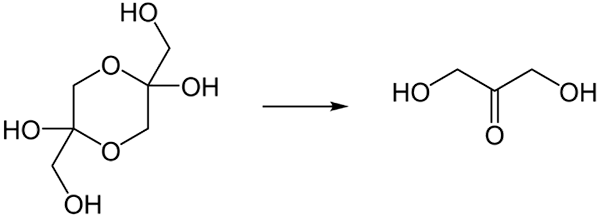 DHA -jeva pretvorba dime v vaš monomer, ko se raztopi v vodi. Vir: Steffen 962 v nemški Wikipediji / javni domeni
DHA -jeva pretvorba dime v vaš monomer, ko se raztopi v vodi. Vir: Steffen 962 v nemški Wikipediji / javni domeni Ker je DHA v svoji zelo higroskopski monomerni obliki, se hitro, ko se je sušila in absorbirala vlaga, vrne k vzpostavitvi dimera s svojim dioksanskim obročem.
Pridobivanje in sintezo
Seveda lahko DHA dobimo tako, da ga izvlečemo iz sladkornih trstič.
Po drugi strani pa je, ko gre za sintezo ali proizvodnjo, več alternativ, vse na podlagi oksidacijske reakcije glicerina. Eden od njih je oksidacija glicerina ali glicerola z vodikovim peroksidom z uporabo železovih soli, kot so katalizatorji. V drugi reakciji glicerin z zrakom, kisikom ali benzokinonom oksidira, vendar z uporabo posebnih paladijskih katalizatorjev.
Vam lahko služi: Perrin atomski model: značilnosti, postulatiImamo tudi metodo komercialne proizvodnje DHA, v kateri se glicerin oksidira z uporabo ocetnih kislih bakterij v procesu fermentacije.
Med sintezo DHA je tudi gliceraldehid, njen strukturni izomer.
Tveganja
Tveganja okoli DHA niso povsem jasna. V svoji fosfaženi obliki je dihidroksiacetonski fosfat produkt glikolize in vmesnega vmesnega metabolizma fruktoze, saj ga izomerazni triozofosfatni encim pretvori v D-gliceraldehid 3-fosfat. Vendar lahko prekomerni odmerek DHA po medicinskih študijah negativno spremeni celoten mehanizem, kar povzroči celo celično smrt.
Zato se DHA šteje za nevarno, če ga zaužije ali če se predvsem vdihava. Poleg tega obstajajo študije, ki potrjujejo, da njihove lokalne aplikacije povečujejo koncentracijo reaktivnih oksigeniranih vrst (ROS), ki napadajo kožne celice, ki proizvajajo njihovo staranje, in pojav gub.
Ta kolateralna reakcija je še bolj poudarjena, ko je koža, impregnirana z DHA.
Strokovnjaki zato priporočajo, da DHA ne uporabljate v zunanjih prostorih takoj po nanosu losjonov za porjavitev na koži.
Da bi zmanjšali to tveganje, losjoni vsebujejo dodatke, kot so zelenjavna in antioksidativna olja, poleg mikrokapsul, ki postopoma sproščajo DHA.
Dihidroxyaceton uporablja
 Tan losjoni, ki vsebujejo DHA, so varnejša možnost, ko koža porjavi, ne da bi se izpostavila sončnim žarkom
Tan losjoni, ki vsebujejo DHA, so varnejša možnost, ko koža porjavi, ne da bi se izpostavila sončnim žarkom Dihidroksiaceton je sinonim za kozmetiko, saj je aktivna sestavina številnih izdelkov za strojenje, kreme, sparties, maske, losjone itd. Pri uporabi teh bronastih na koži se zgodi reakcija MailRD, odgovorna za to pridobi bolj oranžno barvo, ne da bi obiskala plažo ali se izpostavila dolgim uram pod jutranjim soncem.
Lahko vam služi: kemična neprepustnostSprva, do leta 1960, so bili Tan pretirano oranžni, do te mere, da je desetletja širša javnost to vrsto Tannerja zavrnila. Vendar pa so se formulacije izboljševale, tako da je bila porjavela videti bolj naravna, sijoča in prijetna, hkrati pa zagotavljala nižja tveganja po njihovi uporabi.
Različne blagovne znamke, vključno s kanalom Coco, so zmanjšale koncentracije DHA na največ 20%, ki jih vključujejo tudi erith, še en sladkor, ki reagira tudi s kožnimi beljakovinami, in komponente, ki nevtralizirajo učinke UV žarkov. Prav tako so si prizadevali podaljšati trajnost porjavelosti po uporabi.
Dandanes na trg prihajajo novi izdelki za strojenje, ki bodo še naprej razcveteli, dokler medicinske študije ne potrjujejo, da TAN ne uporablja možnih tveganj za aktualno aplikacijo DHA, za katero se verjame.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Cyriminna, r., Fidalgo, a., Ilharco, l. M., & Pagliaro, m. (2018). Dihidroxyaceton: posodobljen vpogled v pomemben bioproduk. Kemija, 7(3), 233–236. doi.org/10.1002/odprto.201700201
- Wikipedija. (2020). Dihidroksiaceton. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Dihidroksiaceton. Pubchem Comunund Povzetek za CID 670. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Mary Gallagher. (2018). Izpostavljenost dihidroksiacetonu v izdelkih brez sonca, ki razume tveganja. Združenje dermatoloških medicinskih sester. Doi: 10.1097/jdn.0000000000000366

