Lastnosti dibenzalacetone, reakcijski mehanizem, uporabe, tveganja

- 2555
- 606
- Dexter Koch
The Dibenzalacetona (DBA) je organska spojina, katere molekularna formula je c17H14Tudi. Je rumenkasto trdno snov, ki je, odvisno od njegove čistosti, predstavljena kot kristali. Uporablja se v kremih za sončenje in organometalno sintezo, v kateri se paladij uporablja kot katalizator.
Medtem ko je njegova sinteza razmeroma preprost, precej ponavljajoč se postopek pri poučevanju laboratorijev za razlago aldolske kondenzacije, je njen mehanizem nekoliko obsežen, upoštevati je treba več dejavnikov. Benzaldehid, ki se uporablja, ki se bo kondenziral z acetonom, mora biti na novo destiliran, da zagotovi njegovo nizko oksidacijo v stiku z zrakom.
 Vzorec dibenzalacetona v stekleni posodi. Vir: Stephanb [CC by-SA (http: // creativeCommons.Org/licence/by-sa/3.0/]]
Vzorec dibenzalacetona v stekleni posodi. Vir: Stephanb [CC by-SA (http: // creativeCommons.Org/licence/by-sa/3.0/]] Prav tako se za solubizacijo reagentov uporablja etanol-vodni medij in hkrati spodbuja končne padavine dibenzalacetona, hidrofobne in netopne spojine. Zaenkrat ni znano, kakšni negativni učinki lahko izvajajo dibenzalaceton na organizem ali okolje, namesto da bi bili dražilna snov.
[TOC]
Lastnosti
Fizični videz
Trden rumenkasto prašen ali kristalni videz.
Molarna masa
234,29 g/mol
Izomeri
Dibenzalaceton je predstavljen kot trije geometrijski izomeri: trans-trans-trans-cis in cis-cis. Izomer trans-trans je ves najbolj stabilen in zato tisti, ki se med sintezo pojavi največ.
Tališče
110-111 ° C. Ta razpon se razlikuje glede na stopnjo čistosti sintetizirane trdne snovi.
Topnost vode
Nerešljiv.
Struktura
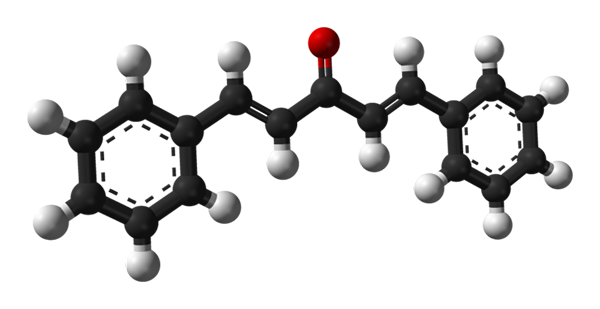 Molekularna struktura dibenzalacetona. Vir: Benjah-BMM27 [javna domena]
Molekularna struktura dibenzalacetona. Vir: Benjah-BMM27 [javna domena] Na zgornji sliki je prikazana molekula trans-trans-trans izomera. V središču njega imamo karbonilno skupino, na njegovih straneh pa dvojne vezi in dva aromatična obroča Bonenceno.
Dibenzalaceton je v apolarnem in hidrofobnem bistvu, saj je celotna struktura praktično sestavljena iz atomov ogljika in vodika. Karbonilna skupina ji daje le majhen dipolski trenutek.
Vam lahko služi: aluminijev fosfuro (AIP): struktura, lastnosti, uporabe, tveganjaStrukturo je mogoče enačiti s strukturo lista, saj imajo vsi njeni ogljikovi atomi hibridizacijo SP2; Zato počivajo v isti ravnini.
Lahki fotoni delujejo s konjugiranim π sistemom dibenzalacetone; zlasti tistih UV sevanja, ki se absorbirajo za vzbujanje preselitvenih elektronov. Ta lastnost naredi dibenzalacetona odlična vpojna ultravijolična svetloba.
Dibenzalacetona reakcijski mehanizem
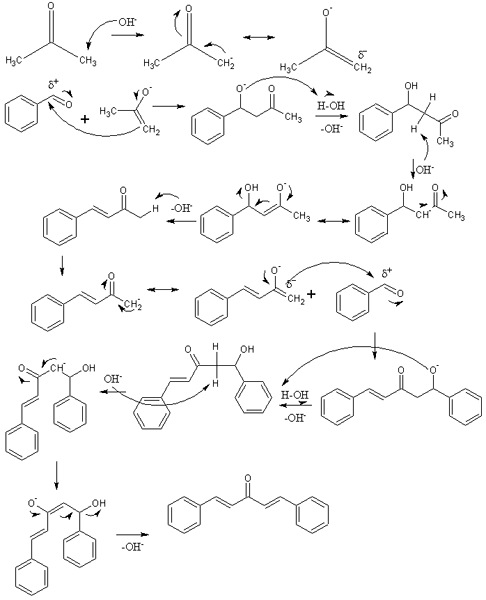 Mehanizem aldolske kondenzacije v sintezi dibenzalacetone. Vir: IZMAELT [CC by-S (https: // createCommons.Org/licence/by-sa/3.0)]
Mehanizem aldolske kondenzacije v sintezi dibenzalacetone. Vir: IZMAELT [CC by-S (https: // createCommons.Org/licence/by-sa/3.0)] Na vrhunski podobi smo predstavljali mehanizem aldolske kondenzacije med benzaldehidom in acetonom, da izvirajo dibenzalaceton; konkretno, njegov trans-trans izomer.
Reakcija se začne z acetonom v osnovnem mediju. Oh- Nespredmetno kisli proton katere koli od njegovih dveh metilnih skupin, -CH3, povzroča nepravilno: cho3C (o) ch2-, ki preseli svojo negativno resonančno obremenitev (prva vrstica slike).
Ta inoolat nato deluje kot nukleofilno sredstvo: napade karbonilno skupino molekule benzaldehida. Njegova vključitev v benzaldehid ustvari alcoksid, ki zato, ker je zelo osnovno opustošenje molekule vode in postane aldol (druga vrstica). Za aldol ali β-hidroksihiton je značilno, da imajo skupine C = O in OH.
Osnovni medij dehidrira ta aldol in dvojna vez se oblikuje v njegovi strukturi, ki ustvarja benzilideneaceton (tretja vrsta). Potem, oh- Tudi neproteran eden od njegovih kislih vodikov, ki ponavlja še en nukleofilni napad na drugo benzaldehidsko molekulo. Tokrat se napad zgodi tako hitro (četrta vrsta).
Izdelek je oblikoval nezaščiteno drugo molekulo vode in spet trpi za dehidracijo za odpravo skupine OH in vzpostavitev druge dvojne vezi (peta in šesta vrsta). Tako in na koncu se pojavi dibenzalacetona.
Vam lahko služi: Boyle LawSinteza
Reagenti
Reagenti za izvedbo sinteze dibenzalacetona so naslednje:
- 95% etanol.
- Na novo destiliran benzaldehid grenkega mandljevega olja.
- NaOH kot osnovni katalizator v destilirani vodi.
Zneske, ki jih je treba uporabiti, so odvisni od tega, koliko dibenzalacetona je namenjen sintetiziranju. Vendar pa obstaja presežek benzaldehida, ker je del oksidiranega v benzojsko kislino. Zagotovljeno je tudi, da reakcija traja manj časa in da se v manjši meri proizvaja nezaželen benzilideneaceton.
Etanol deluje kot topilo benzaldehida, saj se sicer ne bi raztopilo v osnovnem okolju NaOH.
Postopek
V velikem kozarcu oborine etanol pomešamo z benzaldehidom. Nato se med konstantno magnetno vznemirjenostjo doda osnovni medij NaOH. V tem koraku pride do reakcije Cannizzaro; To pomeni, da se dve molekuli benzaldehida nesorazmerno v enem od benzil alkohola in drugega benzojske kisline, ki ga je mogoče zlahka prepoznati po njegovem značilnem sladkem vonju.
Končno dodamo aceton in pričakuje se pol ure, da bo rešitev postala oblačna in rumeno-oranžna barva. Dibenzalacetona se bo zaradi vode oborila, zato se doda veliko količine vode, da se spodbudi njegove popolne padavine.
Dibenzalacetona filtrira v vakuum, njegova rumenkasta snov pa je bila večkrat lava z destilirano vodo.
Prekristalizacija
 Prekristaliziran vzorec dibenzalacetone mora nositi sijaj, podoben kot kristale te slike. Vir: Smokefoot [CC by-SA (https: // createCommons.Org/licence/by-sa/4.0)]
Prekristaliziran vzorec dibenzalacetone mora nositi sijaj, podoben kot kristale te slike. Vir: Smokefoot [CC by-SA (https: // createCommons.Org/licence/by-sa/4.0)] Za čiščenje dibenzalacetona se uporablja 95% etanol ali vroč etil acetat, tako da se za vsakič, ko ponovimo več kristalov čistosti. Tako se bo začetni rumenkast prah spremenil v majhne rumene kristale dibenzalacetone.
Vam lahko služi: benzoijska kislina (C6H5COOH)Prijave
Dibenzalacetona je spojina, ki nima preveč uporabe. Zaradi svoje sposobnosti absorbiranja ultravijolične svetlobe se uporablja pri formulaciji kreme za sončenje ali katerega koli drugega izdelka, ki muči pojavnost UV žarkov, bodisi prevleke ali slike.
Po drugi strani se dibenzalaceton uporablja v organometalni sintezi paladija. Deluje kot vezava, ki koordinira kovinske atome paladija, PD0, Za oblikovanje kompleksa Tris (Dibenzeneacetona) Dipaladio (0).
Ta organometalna spojina zagotavlja atome PD0 V različnih organskih sintezi se tako obnaša kot homogeni katalizator, saj se raztopi v številnih organskih topilih.
Prav tako je dibenzalacetona kot vezivo enostavno nadomestiti z drugimi organskimi vezivi, kar omogoča, da se organometalni sinteza paladija razvije.
Tveganja
Kar zadeva tveganja, ni veliko razpoložljivih informacij, ki poročajo o možnih vplivih na zdravje ali okolje, ki lahko privede do dibenzalacetona. V čistem stanju je dražilna trdna snov za zaužitje, dihanje ali neposreden stik z očmi ali kožo.
Vendar očitno ni dovolj dražilno, da ne more biti del formulacij za sončne kreme. Po drugi strani pa je tako netopna v vodi, njegova koncentracija v njej je zanemarljiva in se predstavlja kot trden onesnaževalec. V tem smislu ni znano, kako škodljivo je za morsko favno ali tla, ki jih povzroča motnost.
Dokler ni prikazano nasprotno.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). Dibenzilideneaceton. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Dibenzilideneaceton. Baza podatkov Pubchem., Cid = 640180. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Organske sinteze. (2020). Dibenzalaceton. Pridobljeno od: Orsyn.org
- Dibenzalaceton z aldolskim kondenzacijo. Pridobljeno iz: splet.Mnstate.Edu
- « Značilnosti toplotnega onesnaževanja, posledice, primeri
- Osnove jodometrije, reakcije, splošni postopek, uporabe »

