Struktura železovega klorida (FECL2), uporabe, lastnosti

- 2395
- 16
- Lee Farrell
On železov klorid Gre za anorgansko trdno snov, ki jo tvori zveza vere2+ in dva aniona klorida Cl-. Njegova kemična formula je FECL2. Ponavadi absorbira vodo iz okolja. Eden od njegovih hidratov je FECL tetrahidrat2 •4H2Ali ki je zelenkasto trdno.
Poudarite, da je v vodi zelo topen in se nagiba v oksidaciji v prisotnosti zraka, ki tvori železov fek klorid3. Za zlahka oksidacijsko in zato sposobno delovati kot reduktor, ki se pogosto uporablja v kemičnih in bioloških raziskovalnih laboratorijih.
 Ferroso tetrahidrat klorid Fecl2 •4H2Ali trdno. Craven [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Ferroso tetrahidrat klorid Fecl2 •4H2Ali trdno. Craven [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Železni klorid ima več namenov, med katerimi lahko pomagajo drugim povzročiteljem pri oksidaciji blata, ki izhaja iz čiščenja odpadne vode ali odplak. Uporablja se tudi v procesu kovinskega železnega premaza in ima nekaj uporabe v farmacevtski industriji.
Izkušena je bila tudi uporaba FECL2 Pri okrevanju dragocenih kovin porabljenih katalizatorjev, ki jih najdemo v izpušnih ceveh vozil, ki delajo z bencinom ali dizlom.
Uporablja se v tekstilni industriji za popravljanje barv v nekaterih vrstah tkanine.
[TOC]
Struktura
Železov klorid tvori ion železov2+ in dva iona klorida Cl- Združeni skozi ionske povezave.
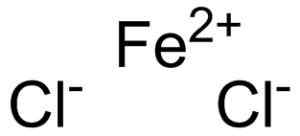 Ferroso Chloruro Fecl2 Kje so ioni, ki jih sestavljajo. EPOP [javna domena]. Vir: Wikimedia Commons.
Ferroso Chloruro Fecl2 Kje so ioni, ki jih sestavljajo. EPOP [javna domena]. Vir: Wikimedia Commons. Železova vera2+ Ima naslednjo elektronsko strukturo:
1s2, 2s2 2 p6, 3s2 3P6 3D6, 4s0
Kjer vidite, da ste izgubili dva elektrona plasti 4S.
Ta konfiguracija ni zelo stabilna in zaradi tega se nagiba k oksidiranju, to je izgubiti drug elektron, tokrat 3D plast, ki tvori vera3+.
Svoj del ionski klorid Cl- Ima naslednjo elektronsko strukturo:
1s2, 2s2 2 p6, 3s2 3P6
Kjer vidite, da ste v sloju 3P pridobili dodaten elektron in ga dokončali. Ta konfiguracija je zelo stabilna, ker so vse elektronske plasti popolne.
Nomenklatura
- Železov klorid
- Železni klorid (ii)
Lahko vam služi: Določitev pepela: metode in primeri- Železni diklorid
- Tetrahidrat železov klorid: FECL2 •4H2Tudi
Lastnosti
Fizično stanje
Barvita do bledo zelena, kristala.
Molekularna teža
126,75 g/mol
Tališče
674 ° C
Vrelišče
1023 ° C
Specifična teža
3.16 do 25 ° C/4 ° C
Topnost
Zelo topno v vodi: 62,5 g/100 ml pri 20 ° C. Topno v alkoholu, acetonu. Rahlo topen v benzenu. Praktično netopna v etru.
Druge lastnosti
Fecl2 brezvodni je zelo higroskopski. Absorbirajo vodo z lahkoto v okolju, ki tvorijo različne hidrate, zlasti tetrahidrat, v katerem za vsako molekulo FECL2 Obstajajo 4 h molekule2Ali povezan s tem (FECL2 •4H2Da).
V prisotnosti zraka počasi oksidira na FECL3. To pomeni, da je vera2+ Enostavno oksidira ionsko vero3+.
Če se segrejete v prisotnosti hitrega zračnega železovega klorida FECL3 In železov oksid Fe2Tudi3.
Fecl2 Jed je za kovine in tkiva.
Pridobivanje
Dobimo ga z obdelavo presežka železove vere z vodno raztopino klorovodikove kisline HCl pri visokih temperaturah.
Vera0 + 2 HCl → FECL2 + 2 h+
Vendar pa zaradi prisotnosti vode s to metodo dobimo železov tetrahidratni klorid2 •4H2Tudi.
Da bi dobili brezvodni (brez vode, vgrajene v kristale) so se nekateri raziskovalci odločili za reakcijo železnega prahu s hribi brezvodni (brez vode) v tetrahidrofuranskem topilu (THF) pri temperaturi 5 ° C.
FECL spojina dobimo na ta način2 •1.5thf, ki se pri segrevanju pri 80-85 ° C v praznini ali v dušikovi atmosferi (da se izognete prisotnosti vode) proizvede FECL2 brezvodna.
Prijave
Železov klorid ima različne namene, ki temeljijo na njegovi zmanjšanju zmogljivosti, to je, da ga je mogoče enostavno oksidirati. Uporablja se na primer na slikah in premazih, saj jih pomaga pritrditi s površine.
Železo je bistveni mikrohranil za zdravje ljudi in nekatere živali. Vključen je v sintezo beljakovin, dihanje in množenje celic.
Zato FECL2 Uporablja se v farmacevtskih pripravkih. Vera ion2+ Kot tak je bolje absorbiran kot vera3+ V črevesju.
Vam lahko služi: kalcijev karbonat: struktura, lastnosti, tvorba, uporabeUporablja se za proizvodnjo FECL3. Uporablja se v metalurgiji, v železnih premazih.
Tu so druge vidne uporabe.
V obarvanju tkanine
Fecl2 V nekaterih vrstah tkanine se uporablja kot mandant ali barvanje. Mordant kemično reagira in se hkrati pridruži barvilu in tkanini, ki tvori netopno spojino na tem.
Na ta način je barvilo pritrjeno na tkanino in njegova barva se okrepi.
 Fecl železovega klorida2 Omogoča, da se barva pritrdi na tkanine. Gina pina [cc by 2.0 (https: // creativeCommons.Org/licence/by/2.0)]. Vir: Wikimedia Commons.
Fecl železovega klorida2 Omogoča, da se barva pritrdi na tkanine. Gina pina [cc by 2.0 (https: // creativeCommons.Org/licence/by/2.0)]. Vir: Wikimedia Commons. Pri čiščenju odpadne vode
Fecl2 Uporablja se v odpadnih vodah ali čistilnih napravah (kanalizacijske vode).
V tej aplikaciji železov klorid sodeluje pri oksidaciji blata s postopkom, imenovanim fentonsko oksidacijo. Ta oksidacija povzroči rupturo blata in omogoča sproščanje vode, ki je na to močno pritrjena.
 Odsek čistilne naprave, kjer lahko vidite blato. Včasih se to zdravi s ferroso feCl kloridom2 tako da ga je mogoče lažje ločiti od vode. Evelyn Simak/Kanalizacije deluje severno od Dickleburga. Vir: Wikimedia Commons.
Odsek čistilne naprave, kjer lahko vidite blato. Včasih se to zdravi s ferroso feCl kloridom2 tako da ga je mogoče lažje ločiti od vode. Evelyn Simak/Kanalizacije deluje severno od Dickleburga. Vir: Wikimedia Commons. Potem se lahko blato posuši in zavrže. Uporaba železovega klorida pomaga zmanjšati stroške procesa.
Pred kratkim je bilo predlagano tudi za zmanjšanje tvorbe sulfidnega plina ali vodikovega sulfida v omenjenih kanalizaciji kanalizacije.
Na ta način bi se korozija, ki jo proizvaja ta plin, zmanjšali.
V kemijskih študijah
Za svoje zmanjševanje lastnosti (nasprotno od oksidacije) FECL2 Široko se uporablja v različnih raziskavah kemije, fizike in inženirskih laboratorijev.
Nekateri znanstveniki so uporabili hlapi železov klorida.
Ti katalizatorji se uporabljajo za odpravljanje škodljivih plinov za človeka in okolje. Nahajajo se v cevi za pobeg avtomobilov in tovornjakov, ki delujejo z bencinom ali dizlom.
Vam lahko služi: molarna masa: kako se izračuna, primeri in rešene vaje Izpušna cev vozila, kjer opazimo bolj voluminozen odsek, kjer se nahaja katalizator za pretvorbo škodljivih plinov v prijazne pline z okoljem. Ahanix1989 na angleški Wikipediji [javna domena]. Vir: Wikimedia Commons.
Izpušna cev vozila, kjer opazimo bolj voluminozen odsek, kjer se nahaja katalizator za pretvorbo škodljivih plinov v prijazne pline z okoljem. Ahanix1989 na angleški Wikipediji [javna domena]. Vir: Wikimedia Commons. Po določenem času se porabi katalizator vozila in izgubi učinkovitost in ga morate zamenjati. Porabljeni katalizator se zavrže in si prizadevajo za povrnitev dragocenih kovin, ki jih vsebuje.
 Keramična mreža katalizatorja, kjer se nahajajo sledovi dragocenih kovin, ki jih je treba okrevati s FECL2. Recikliranje globalnega kat [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Keramična mreža katalizatorja, kjer se nahajajo sledovi dragocenih kovin, ki jih je treba okrevati s FECL2. Recikliranje globalnega kat [CC by-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Po mnenju raziskovalcev so z železom železovega klorida te kovine tvorili magnetne zlitine.
Zlitine bi lahko ekstrahirali z magnetom in nato obnovili dragocene kovine z že znanimi metodami.
V biokemijskih študijah
Za posedovanje vere2+, ki je pomemben mikrohranil pri človeku in nekaterih živalih, FECL2 Uporablja se v študijah biokemije in medicine.
Nekatere študije so lahko pokazale, da železov klorid izboljšuje glivicidno učinkovitost agonske hladne plazme.
Hladna plazma je tehnologija, ki se uporablja za sterilizacijo medicinskih površin in instrumentov. Temelji na tvorbi hidroksilnih radikalov OH · iz vlažnosti okolja. Ti radikali reagirajo s celično steno mikroorganizma in povzročajo njihovo smrt.
V tej preiskavi FECL2 Učinek hladne plazme je izboljšal in pospešil izločanje glive, odporne na druge metode dezinfekcije.
Nekateri znanstveniki so ugotovili, da uporaba FECL2 Omogoča povečanje učinkovitosti pri pridobivanju glukoze, ki temeljijo na bagasseju sladkornega trsa.
V tem primeru je vera2+ Bistveno mikroenergijo za zdravje ljudi, njegova prisotnost v sledovih v izdelku ne bi vplivala na človeka.
Reference
- Fukuda, s. et al. (2019). Železov klorid in železov sulfat izboljšujeta glivicidno učinkovitost hladne atmosferske argonske plazme na melanizirani aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28–32. NCBI si je opomogel.CLM.ameriški nacionalni inštitut za zdravje.Gov.
- Ismal, ali.In. in yildirim, l. (2019). Kovinski gagi in biomordant. V vplivu in možnosti zelene kemije za tekstilno tehnologijo. Poglavje 3, str.57-82. Okrevano od Scientirect.com.
- Zhang, w. et al. (2019). Kosataliza magnezijevega klorida in železovega klorida za ksilo-oligosaharide in proizvodnjo glukoze iz sladkornega trsa Bagasse. Bioresoral Technol 2019, 291: 121839. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Zhou, x. et al. (2015). Vloga avtohtonega železa pri izboljšanju desiliranja blata Ta peroksidacija. Znanstvena poročila 5: 7516. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Rathnayake, d. et al. (2019). Nadzor vodikovega sulfida v kanalizaciji s katalizacijo reakcije s kisikom. Znanost o celotnem okolju 689 (2019) 1192-1200. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Taninouchi in. in okabe, t.H. (2018). Obna. Metall in Materi Trans B (2018) 49: 1781. Povezava je bila obnovljena.Springer.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Železov klorid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Aresta, m. et al. (1977). Železo (0) oksidacija z vodikovim kloridom v tetrahidrofuranu: preprosta pot do brezvoljnega železa (ii) klorid. Anorganska kemija, Vol. 16, ne. 7, 1977. Okrevani iz lokalov.Acs.org.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- « Zgodovina in pomen Portugalske zastave (revidirane slike)
- Izvor krščanske etike, temelji, predstavniki »

