Svinčene lastnosti klorida, struktura, uporabe

- 2437
- 684
- Adrian Legros
On svinčeno klorid To je anorganska sol, katere kemična formula je PBCLn, Kjer je n oksidacijska številka svinca. Torej, ko je svinec podoben +2 ali +4, je sol pbcl2 ali pbcl4, oziroma. Zato obstajata dve vrsti kloridov za to kovino.
Od obeh, pbcl2 Je najpomembnejši in stabilen; medtem ko pbcl4 je nestabilen in manj uporaben. Prva je ionske narave, kjer kation pb2+ ustvarja elektrostatične interakcije s cl anionom- zgraditi kristalno omrežje; In drugi, je kovalenten, s povezavami PB-Cl, ki izvirajo s svincem in klorom.
 Oborjene igle PBCL2. Vir: rrausch1974 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Oborjene igle PBCL2. Vir: rrausch1974 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Druga razlika med svinčenimi kloridi je, da je PBCL2 Je trdna kristala v obliki belega stekla (nadrejena slika); medtem ko pbcl4 Je rumenkasto olje, ki lahko kristalizira pri -15 ° C. PBCL vhod2 Je bolj estetska kot PBCL4.
Poleg omenjenega PBCL2 V naravi ga najdemo kot mineral kotunita; medtem ko pbcl4 Ne, saj je dovzetna za razgradnje. Medtem ko iz PBCL4 Lahko dobite PBO2, PBCL2 Izpeljajo neskončno raznolikost organometalnih spojin.
[TOC]
Lastnosti
Lastnosti svinčevega klorida so odvisne v bistvu oksidacijske številke svinca; Ker se klor ne spreminja, ampak ali tako vpliva na svinca. Zato je treba obravnavati obe spojini; svinčeno klorid (ii) na eni strani in svinčeno klorid (iv) na drugi.
-Svinčni klorid (ii)
Molarna masa
278,10 g/mol.
Fizični videz
Belo obarvani kristali z iglami.
Gostota
5,85 g/ml.
Tališče
501 ° C.
Vrelišče
950 ° C.
Topnost vode
10,8 g/l pri 20 ° C. Je malo topna in voda je treba segreti, tako da se lahko raztopi precejšnja količina.
Lahko vam služi: nikelj hidroksid (ii): struktura, lastnosti, uporabe, tveganjaLomni količnik
2.199.
Svinčni klorid (iv)
Molarna masa
349,012 g/mol.
Fizični videz
Rumenkasto mastna tekočina.
Gostota
3.2 g/ml.
Tališče
-15 ° C.
Vrelišče
50 ° C. Pri višjih temperaturah razbije sproščanje plinastega klora:
Pbcl4(s) => pbcl2(s) + cl2(g)
Pravzaprav je ta reakcija lahko zelo eksplozivna, zato je PBCL shranjen4 V žveplovi kislini pri -80 ° C.
Struktura
-Svinčni klorid (ii)
Sprva je bilo omenjeno, da je PBCL2 Je ionska spojina, zato je sestavljena iz PB ionov2+ in Cl- ki gradijo kristal, v katerem je vzpostavljeno razmerje PB: Cl enak 1: 2; To pomeni, da je dvakrat tudi anionov- Kakšne katione pb2+.
Rezultat tega je, da se oblikujejo ortorambični kristali, katerih ioni so lahko predstavljeni z modelom kroglic in palic kot na spodnji sliki.
 Kotunitna struktura. Vir: Benjah-BMM27 [javna domena].
Kotunitna struktura. Vir: Benjah-BMM27 [javna domena]. Ta struktura ustreza tudi strukturi minerala Cotunit. Čeprav se palice uporabljajo za označevanje usmeritve ionske povezave, je ne smete zamenjati s kovalentno (ali vsaj čisto kovalentno) povezavo).
V omenjenih ortorrombičnih kristalih PB2+ (Grilska sfere) ima devet cl- (zelene sfere), ki ga obdaja, kot da je zaprt v trikotni prizmi. Za zapleteno strukturo in nizko ionsko gostoto PB2+, Molekule je težko rešiti kozarec; razlog, zakaj je v hladni vodi malo topen.
Plinasta fazna molekula
Kadar se niti kristal niti tekočina ne moreta upreti visokim temperaturam, se ioni začnejo izhlapevati kot molekule PBCL2 diskretno; to pomeni, da s kovalentnimi vezmi CL-PB-Cl in kotom 98 °, kot da bi bil boomerang. Nato rečemo, da plinsko fazo sestavljajo te molekule PBCL2 in ne ionov, ki jih nosijo zračni tokovi.
Vam lahko služi: elektronegativnostSvinčni klorid (iv)
Medtem pbcl4 Je kovalentna spojina. Ker? Ker kation pb4+ Je manjša in ima tudi večjo gostoto obremenitve ionov kot PB2+, ki povzroča večjo polarizacijo elektronskega oblaka CL-. Rezultat tega je, da namesto interakcije ionskega tipa PB4+Cl-, PB-CL kovalentna povezava je oblikovana.
Glede na to se razume podobnost med PBCL4 In na primer CCL4; Oba sta predstavljena kot tetraedrska individualna molekula. Tako je razloženo, zakaj je ta svinčen klorid v normalnih pogojih rumenkasto olje; Atomi CL so nekaj povezani med seboj in "zdrsne", ko dve molekuli PBCL4 prihajajo.
Ko pa se temperatura spusti in molekule postanejo počasnejše, se povečajo verjetnost in učinki takojšnjih dipolov (PBCL4 Je apolarna glede na svojo simetrijo); In potem olje zamrzne kot rumeni šesterokotni kristali:
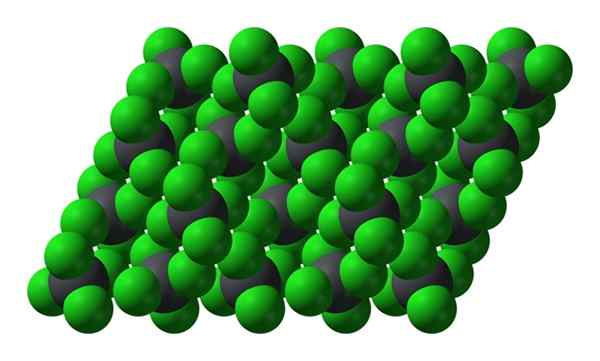 Kristalna struktura PBCL4. Vir: Benjah-BMM27 [javna domena]
Kristalna struktura PBCL4. Vir: Benjah-BMM27 [javna domena] Upoštevajte, da je vsaka sivkasta krogla obdana s štirimi zelenimi sferami. Te molekule PBCL4 "Squeered" sestavljajo nestabilen kristal in dovzetni za razgradnjo.
Nomenklatura
Imena: svinčni klorid (II) in svinčni klorid (IV) ustrezata tistim, dodeljenim v skladu z nomenklaturo zalog. Ker je oksidacijska številka +2 najmanjša za svinca in +4 največja, lahko oba klorida poimenujeta po tradicionalni nomenklaturi kot Plumbuse klorid (PBCL2), in plúbic klorid (pbcl4).
In končno je sistematična nomenklatura, ki poudarja število vsakega atoma spojine. Tako pbcl2 Je svinčev diklorid in pbcl4 svinčeno tetraklorid.
Lahko vam služi: kemična neprepustnostPrijave
Praktična uporaba za PBCL ni znana4 Poleg serviranja sinteze PBO2. Vendar PBCL2 Bolj je koristno in zato bodo spodaj navedene le nekatere uporabe za ta specifični klorid:
- Zaradi svoje zelo svetlobne narave je namenjen fotografskim, akustičnim, optičnim in sevalnim detektorjem.
- Ne absorbira v infrardečem spektru, se uporablja za izdelavo stekla, ki prenaša to vrsto sevanja.
- Bil je del tega, kar imenujejo Aureno Glass, privlačnega materiala prelivnih modrikastih obarvanj, ki se uporabljajo za okrasne namene.
- Tudi po temi umetnosti, ko ste doseženi, pbcl2· PB (OH)2 pridobi intenzivne belkaste odtenke z uporabo belega svinčevega pigmenta. Vendar je bila njegova uporaba zaradi visoke strupenosti odvrnjena.
- Topljen in pomešan z barijevim titanatom, Batio3, izvira titanato keramika iz barija in svinca BA1 - xPbxStric3. Če pb2+ Vstopite v batio3, Ba2+ Morate pustiti kozarec, da dovolite njegovo vključitev, nato pa se reče, da pride do izmenjave kationov; Zato sestava BA2+ Izražena je kot 1-x.
- In končno, iz PBCL2 Več organometalnih spojin splošne formule rumule je sintetiziranih r4Pb ali r3PB-PBR3.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Svinec (ii) klorid. Pridobljeno iz: v.Wikipedija.org
- Kemična formulacija. (2019). Svinčni klorid (iv). Obnovi se od: quimica formulacije.com
- Clark Jim. (2015). Kloridi ogljika, silicija in svinca. Okrevano od: Chemguide.co.Združeno kraljestvo
- Spektralne in optične nelinearne študije s svinčevim kloridom (PBCL2) Kristali. [PDF]. Okreval od: shodhganga.Infibnet.AC.v
- Nacionalni center za informacije o biotehnologiji. (2019). Svinčeno klorid. Baza podatkov pubchem; Cid = 24459. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- « Lastnosti manganovega klorida, strukture, uporabe, tveganja
- Pretvorba stane, kako izračunani in primeri »

