Lastnosti manganovega klorida, strukture, uporabe, tveganja

- 1654
- 113
- Percy Feeney
On Mangan klorid To je anorganska sol, katere kemična formula je MCL2. Sestavljen je iz Mn ionov2+ in Cl- v razmerju 1: 2; Za vsako kation mn2+ Iz anionov CL je dvakrat-.
Ta sol lahko tvori več hidratov: mncl2· 2H2Ali, (dihidrat), mcl2· 4H2Ali (tetrahidrat) in mcl2· 6H2Ali (heksahidrat) najpogostejša oblika soli je tetrahidrat.
 Kristali roza manganov klorida. Vir: Ondřej Mangl [javna domena]
Kristali roza manganov klorida. Vir: Ondřej Mangl [javna domena] Na fizikalne lastnosti manganovega klorida, kot so gostota, taljenje in topnost v vodi. Na primer, tališče v obliki anhidra je veliko večje kot v obliki tetrahidrata.
Barva manganovega klorida je bledo roza (superiorna slika). Bledica je značilna za prehodne kovinske soli. Manganov klorid je šibka kislina Lewis.
Mineral, znan kot Escacquita, je naravna brezvodna oblika manganovega klorida (II); Kot Kempita.
Mangan klorid (II) se uporablja kot sredstvo za zlitino; Katalizator v reakcijah kloriranja itd.
[TOC]
Fizične lastnosti
Fizični videz
- Oblika anhidra: roza kubični kristali.
- Oblika tetrahidrata: rahlo občutljivo rdečkasto monoklinični kristali.
Molarne mase
- Anhidro: 125.838 g/mol.
- Dihidrardeni: 161.874 g/mol.
- Tetrahidrat: 197,91 g/mol.
Fuzijske točke
- Anhidro: 654 ° C.
- Dihidrardena: 135 ° C.
- Tetrahidrat: 58 ° C.
Vrelišče
Oblika Anhidra: 1.190 ° C.
Gostote
- Brezvodna: 2.977 g/cm3.
- Dihidrardena: 2,27 g/cm3.
- Tetrahidrat: 2,01 g/cm3.
Topnost vode
Anhidra oblika: 63,4 g/100 ml pri 0 ° C; 73,9 g/100 ml pri 20 ° C; 88,5 g/100 ml pri 40 ° C; in 123,8 g/100 ml pri 100 ° C.
Topnost v organskih topilih
Topno v piridinu in etanolu, netopna v etru.
Razgradnja
Če se ne upoštevajo ustrezni varnostni ukrepi, lahko dehidracija hidriranih oblik v brezvodni obliki povzroči hidrolitno dehidracijo, s proizvodnjo vodikovega klorida in manganovega oksiklorida.
ph
0,2 M raztopina tetrahidratnega manganovega klorida v vodni raztopini ima pH 5,5.
Vam lahko služi: kromatogramStabilnost
Je stabilen, vendar občutljiv na vlago in nezdružljiv z močnimi kislinami, reaktivnimi kovinami in vodikovim peroksidom.
Struktura mangana klorida
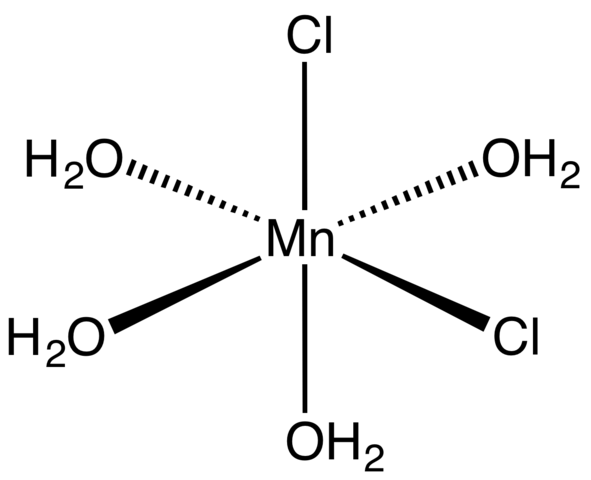 Koordinacijski kompleks za tetrahidrat MNCL2. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Koordinacijski kompleks za tetrahidrat MNCL2. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Začenši s tetrahidratno sol. V njih je kovinski center Mn2+ je obdan z oktaedronom, ki ga definirajo štiri H molekule2Ali in dva aniona-.
Upoštevajte, da CL ligandi- So v položajih CIS; Vsi so enakovredni v pravokotni bazi oktaedra in ni pomembno, ali je Cl "premaknjen"- na katero koli od drugih treh položajev. Drug možen izomer za to usklajeno molekulo je, v kateri sta oba Cl- So v trans položajih; torej na različnih koncih (eden zgoraj in drugo spodaj).
Štiri molekule vode s svojimi vodikovimi mostovi omogočajo, da se dve ali več oktaedri pridružijo sile Dipole-Dipolo. Ti mostovi so zelo usmerjeni in dodajajo elektrostatične interakcije med MN2+ in Cl-, Vzpostavijo urejeno strukturo, značilno za kristal.
Roza barva mncl2· 4H2Ali je posledica elektronskih prehodov MN2+ in njena D konfiguracija5. Prav tako motnje, ki jih povzročajo v bližini molekul vode in kloridi5 Potovati višje ravni energije.
Dihidrat
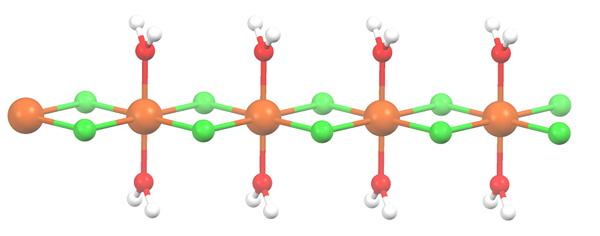 Polimerna struktura za mncl2 · 2H2O. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Polimerna struktura za mncl2 · 2H2O. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Sol je dehidrirana in njegova formula zdaj postane mcl2· 2H2Tudi. Kaj se zgodi s sprednjim oksom? Nič, razen tega, da dve H molekuli2Ali da so zapuščeni, nadomestita dva Cl-.
Sprva lahko daste napačen vtis, da obstajajo štirje CL- za vsak MN2+; Vendar je polovica oktaedra (aksialno) pravzaprav ponavljajoča se enota stekla.
Tako je res, da obstaja MN2+ koordinirano pri dveh CL- in dve molekuli vode v trans položajih. Toda da ta enota lahko komunicira z drugo, potrebuje dva mostova CL, kar posledično omogoča, da se koordinacijski oktaedron zaključi.
Vam lahko služi: diatomični elementiPoleg mostov CL molekule sodelujejo tudi s svojimi vodikovimi mostovi, tako da je ta MNCL veriga2· 2H2Ali ne razorožite.
Brezvodna
Končno je magnezijev klorid končal z izgubo vso vodo, ki jo vsebuje kristala; Zdaj imate anhidra sol, mcl2. Brez molekul vode kristali znatno izgubijo intenzivnost njihovih roza obarvanj. Oktahedron, kot za hidrate, ostaja nespremenjen zaradi same manganove narave.
Brez molekul vode, mn2+ konci, obkroženi z oktaedronom, sestavljenim samo iz Cl-. Ta koordinacijska povezava ima tako kovalenten kot ionski značaj; Zaradi tega se običajno nanaša na strukturo MNCL2 kot polimerni kristal. V njem so nadomestne plasti Mn in Cl.
Nomenklatura
Mangan ima veliko možnih stanj oksidacije. Zaradi tega je tradicionalna nomenklatura za MNCL2 Ni razjasnjeno.
Po drugi strani manganov klorid ustreza njegovemu najbolj znanemu imenu, ki mu manjka, da bi dodali '(ii)', tako da je v skladu z zalogami nomenklature: manganov klorid (ii). In Asçi je sistematična nomenklatura: manganov diklorid.
Prijave
Laboratorij
Manganov klorid služi kot katalizator za kloriranje organskih spojin.
Industrija
Manganov klorid se uporablja kot surovina za izdelavo antiartizantov za bencin; varilni material za nefarrozne kovine; Posrednik v izdelavi pigmentov; In oljna pijača Linaza.
Uporablja se v tekstilni industriji za tiskanje in barvanje; v proizvodnji več manganovih soli, vključno s trikarbonom metilciklopentadienilmanganese, ki se uporablja kot opečno barvilo; in pri proizvodnji posušenih električnih baterij.
Manganov klorid se uporablja kot sredstvo za zlitino in se doda staljenem magneziju za proizvodnjo manganovih zlitin; kot posrednik pri pripravi sušilnih sredstev za barvanje in lak; in kot sestavni del dezinfekcij.
Vam lahko služi: natrijev hidroksid (NaOH): struktura, lastnosti, uporabe, sintezaUporablja se tudi pri čiščenju magnezija.
Gnojila in krma za živali
Manganov klorid se uporablja kot vir mangana, elementa, ki se, čeprav ni primarni prehranski element za rastline, kot so dušik, fosfor in kalij, uporablja v številnih biokemičnih reakcijah teh živih bitij teh živih bitij.
Dodaja tudi krmo plemenskih živali za oskrbo mangana, kar bistveno oligočnost za rast živali.
Manganov klorid je prehranska sestavina, ki oskrbuje mangan, element, ki posega v številne procese, potrebne za življenje, vključno s: sintezo maščobnih kislin in spolnih hormonov; asimilacija vitamina E; proizvodnja hrustanca; itd.
Tveganja
Lahko nastane s stikom s kožno rdečico, draženjem in dolgotrajno izpostavljenostjo dermatitisa. Mangan klorid povzroča pordelost, bolečino in solzo.
Z vdihavanjem soli, vneto grlo in pomanjkanje diha. Po drugi strani bi lahko zaužitje prišlo do bruhanja, slabosti in driske.
Prekomerno kronično vdihavanje te soli lahko privede do pljučnega vnetja in kasnejše reaktivne bolezni dihalnih poti.
Njegova prekomerna zaužitje lahko povzroči duševne motnje, dehidracijo, hipotenzijo, odpoved jeter in ledvic, odpoved in smrt multiorganskega sistema.
Nevrotoksičnost je začetna manifestacija nezaželenega delovanja mangana, ki lahko predstavlja glavobole, omotico, izgubo spomina, hiperrefleksijo in blag tremor.
Huda strupenost se kažejo simptomi in znaki, podobni tistim, ki jih opazimo pri Parkinsonovi bolezni.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Mangan (ii) klorid. Pridobljeno iz: v.Wikipedija.org
- Sky Spring Nanomaterials. (2016). Mangan klorid v prahu. Okreval od: ssnano.com
- Kemijska knjiga. (2017). Kloridni mangan. Obnovi se od: Kemicalbook.com
- Toksikološko podatkovno omrežje. (s.F.). Kloridni mangan. Toxnet. Okrevano od: Toxnet.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Gérard Cahiez. (2001). Mangan (ii) klorid. doi.org/10.1002/047084289X.RM020
- Nacionalni center za informacije o biotehnologiji. (2019). Mangan diklorid. Baza podatkov Pubchem. Cid = 24480. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Webconsultas Healthcare, s.Do. (2019). Minerali: mangan. Obnovi se od: spletni svetovalci.com

