Živosrebrni klorid (ii) struktura, lastnosti, pridobivanje, uporabe

- 2419
- 591
- Don Nitzsche
On Živo srebro klorid (ii) Gre za anorgansko spojino, ki jo tvori atom kovinskega živega srebra (HG) in dva atoma klorovega halogena (CL). Živo srebro je v svojem +2 oksidacijskem stanju in kloru -1.
Njegova kemična formula je HGCL2. Je rahlo hlapna kristalna trdna snov pri sobni temperaturi. Sindikati med njihovimi atomi so bolj kovalentni kot ionski.
 Živo srebro klorid (ii). MRGREEN71/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Živo srebro klorid (ii). MRGREEN71/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. Pri raztapljanju v vodi vzdržuje svojo molekularno strukturo. Topno je tudi v več organskih topilih. Ob svetlobi ponavadi tvori kovinsko živo srebro.
V preteklosti so ga uporabljali kot antiseptik in za zdravljenje nekaterih nalezljivih bolezni, tako pri ljudeh kot pri živalih. Tudi kot insekticid za nadzor škodljivcev, kot so mravlje in termiti.
Ko pa je preverjena njihova visoka strupenost, je bila večina teh naprav opuščena in se trenutno uporablja le v kemiji ali biokemični analizi Laboratories.
Lahko izkorišča pod določenimi pogoji. To je strupena spojina, škoduje ljudem, živalim in rastlinam. Nikoli ga ne bi smeli zavreči v okolje. Sumimo tudi, da je rakotvornik.
[TOC]
Struktura
Živosrebrni klorid je sestavljen iz HG v oksidaciji II in kloru z Valencijo -1. V tem haluro imajo povezave med atomi zelo označen kovalenten značaj.
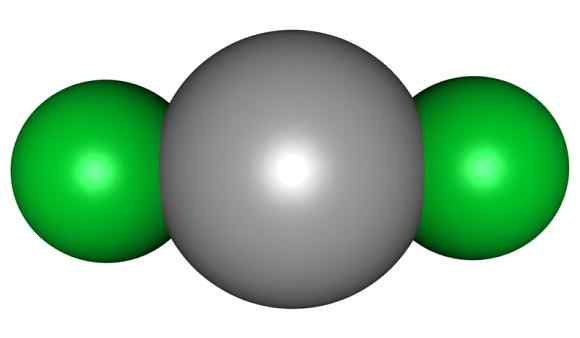 HGCL molekula2. Sivo = živo srebro; Zelena = klor. ArrowsMaster / javna domena. Vir: Wikimedia Commons.
HGCL molekula2. Sivo = živo srebro; Zelena = klor. ArrowsMaster / javna domena. Vir: Wikimedia Commons. To pomeni, da v kozarcu spojina ohranja svojo molekularno strukturo Cl-HG-CL, kjer je razdalja Hg-CL podobna, ko je v plinastem stanju, v kozarcu starejši.
 Ureditev molekul HGCL2 V kozarcu. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons.
Ureditev molekul HGCL2 V kozarcu. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons. V plinastem stanju je očitno molekularna in tudi v vodni raztopini.
Nomenklatura
- Živo srebro klorid (ii)
- Mercuric klorid
- Živo srebro biklorid
- Dikloromercurio
Lastnosti
Fizično stanje
Beli kristalni trdni, rombični kristali.
 Trden merkurični klorid. Leiem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Trden merkurični klorid. Leiem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Molekularna teža
271,5 g/mol
Tališče
280 ° C
Sublimacijska točka
Pri 300 ° C sublima, to pomeni, da gre neposredno iz plinske trdne snovi.
Gostota
5.6 g/cm3
Topnost
Majhna voda topna: 7,31 g/100 ml pri 25 ° C. Alkohol topno: 33 g/ 100 ml pri 25 ° C. Etil acetat topno. Malo topno v etru: 4 g/100 ml. Nekaj topnega v benzenu.
Lahko vam služi: Helmholtz brezplačna energija: enote, kako se izračuna, rešene vajeph
Raztopina 0,2 mola/L ima pH 3,2-4,7.
Kemične lastnosti
V vodni raztopini je skoraj izključno (∼ 99%) v obliki molekule HGCL2. Vendar trpi nekaj hidrolize:
HGCL2 + H2Ali ⇔ hg (oh) cl + h+ + Cl-
HGCL2 + 2 h2Ali ⇔ hg (OH)2 + 2 h+ + 2 Cl-,
Predstavlja izrazito topnost v organskih topilih, kjer je v obliki dimerjev, torej dveh vezanih molekul.
V prisotnosti organske snovi in z delovanjem sončne svetlobe se zmanjša, ki tvori živosrebrni klorid (i) (HGCL) in nato kovinsko živo srebro.
HGCL2 + Sončna svetloba → HGCL → HG0
Z raztopino natrijevega hidroksida (NaOH) ustvari rumeno prekurum rumeno oborino (HGO).
Je nezdružljiv ali reagira z oblikami, sulfiti, fosfati, sulfidi, želatini, albuminom, alkalijem, amonijakom, kalcijevim hidroksidom, bromidom, karbonatom, železom, bakerjem, svincem, srebrnimi soli in nekaterimi rastlinskimi materiali.
Druge lastnosti
Med drugim zaradi svojega najbolj kovalentnega kot ionskega značaja je pri sobni temperaturi rahlo hlapna in je znatno hlapna pri 100 ° C.
Pridobivanje
Lahko pripravite oksidacijo kovinskega živega srebra (HG0) s klorovim plinom (Cl2). Pri segrevanju in doseganju več kot 300 ° C se pojavi plamen in zbira se para, ki se zbira in ko tvorijo kristali HGCL2.
HG + Cl2 + Toplota → HGCL2
Dobimo ga tudi s segrevanjem živega srebrega sulfata (ii) suho z natrijevim kloridom. HGCL hlapi2 da se subliman zbira in kondenzira na kristalno trdno snov.
HGSO4 + 2 NaCl → HGCL2 + Na2SW4
Reakcija med živosreznim oksidom (II) s klorovodikovo kislino v stehiometričnih količinah povzroči kristale HGCl2 Ko se medij ohladi.
HGO + 2 HCl → HGCL2 + H2Tudi
Kristale lahko očistimo s prekristalizacijo in sublimacijo.
Prijave
V kemičnih laboratorijih
Uporablja se kot reagent v različnih kemičnih analizah. Omogoča pripravo drugih živosrebrnih spojin, kot so živosrezni jodid (II), živosreni oksid (II), živosreb.
Lahko vam služi: fluorid: zgodovina, lastnosti, struktura, pridobivanje, tveganje, uporabeV patoloških laboratorijih
Je del ocetne raztopine Zenkerja, ki se uporablja za zdravljenje vzorcev ali vzorcev biopsij kostnega mozga. Tkiva se hitro nastavijo z odličnimi histološkimi podrobnostmi, ki jih je treba opaziti z mikroskopom.
 Včasih hgcl2 Uporablja se v patoloških laboratorijih. Avtor: Ernesto Eslava. Vir: Pixabay.
Včasih hgcl2 Uporablja se v patoloških laboratorijih. Avtor: Ernesto Eslava. Vir: Pixabay. Zapuščene uporabe
V srednjeveških časih in do začetka XX so ga uporabljali v različnih aplikacijah, saj je bil njegov škodljivi učinek za zdravje neznan.
- Kot zdravljenje nekaterih bolezni topikalno antiseptik in razkužilo.
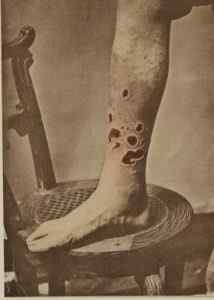 V preteklosti HGCL2 Uporabljali so ga za zdravljenje sifilisa. G. H. Lisica / javna domena. Vir: Wikimedia Commons.
V preteklosti HGCL2 Uporabljali so ga za zdravljenje sifilisa. G. H. Lisica / javna domena. Vir: Wikimedia Commons. - V veterinarski medicini kot kavstični, dezinfekcijski in antiseptični sredstvo.
- V kmetijstvu je deloval kot fungicid, da bi nadzoroval kopenske črve, kot so insekticid in odbojnik ščurkov, mravlje in termitov ter kot razkužilo za zaščito semen in žarnic.
- Za ohranjanje lesa kemično sredstvo za balzamiranje in prihrani anatomske vzorce.
- Kot katalizator pri pridobivanju vinil klorida iz acetilena.
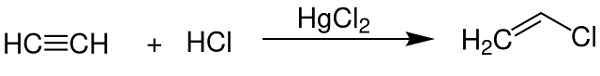 Živosrebrni klorid (II) služi kot katalizator pri pridobivanju nekaterih kemičnih spojin. Chem SIM 2001 / javna domena. Vir: Wikimedia Commons.
Živosrebrni klorid (II) služi kot katalizator pri pridobivanju nekaterih kemičnih spojin. Chem SIM 2001 / javna domena. Vir: Wikimedia Commons. - V aluminijasti elektrodi.
- Za označevanje železa in jekla.
- Kot fotografija reagent.
- V tiskanju tkanine, kot mordant za zajčje in ricinusovo krzno, za barvanje lesa.
- Kot sestavni del posušenih baterij.
Tveganja
Do zdravja
Je jedko in izjemno strupena spojina, če je zaužita, saj lahko povzroči smrt. Napada prebavne trakta in ledvični sistem. Povzročajo hude opekline na koži in očeh.
Dolgotrajna ali večkratna izpostavljenost tej spojini povzroči poškodbe notranjih organov. Vse oblike živega srebra so strupene in HGCL2 je ena najbolj strupenih.
Sumimo, da je karcinogen, ki povzroča genetske napake in poškodbe plodnosti.
Požarna nevarnost
Čeprav gorivo ne more eksplodirati, ko nanašate toploto. Ko razgradi strupene in živosrebrne strupene pline.
HGCL mešanice2 Z alkalnimi kovinami, kot sta natrij ali kalij, so zelo občutljivi na udarce in lahko izkoriščajo udarce. Če pridete v stik z amoniakom, lahko eksplodirajo tudi sulfidi, oksalna kislina in acetilen.
Vam lahko služi: klorovodikova kislina (HCl)Učinki na okolje
Je zelo strupen za vodne in kopenske organizme, njegovi učinki trajajo sčasoma. Lahko predstavlja bioakumulacijo v celotni prehranski verigi, tako v rastlinah kot v živalih.
 Mercuric klorida v okolju nikoli ne smete zavreči. Avtor: Naadjuuh. Vir: Wikimedia Commons.
Mercuric klorida v okolju nikoli ne smete zavreči. Avtor: Naadjuuh. Vir: Wikimedia Commons. Vpliva na dihanje, fotosintezo in druge presnovne poti rastlin, ki povzročajo njihovo poslabšanje. Njegova razporeditev v okolju (niti voda niti tla niti atmosfera) ne bi smela vplivati).
Nevarna prisotnost v nekaterih naravnih pravnih sredstvih
Kljub svoji toksičnosti obstajajo naravna zdravila in zelišča, ki vsebujejo, zato so ljudje, ne da bi to vedeli, nevarno izpostavljeni tej spojini.
Na primer, v tradicionalni kitajski medicini Calomel ali Qing Fen vsebuje nekaj HGCL2. To je zdravilo, ki se uporablja kot diuretik, antiseptični, kožni mazil, odvajalo in se uporablja zunaj za nelagodje za zob pri otrocih.
 Nekatera naravna zdravila, ki jih nadzorujejo ZN, lahko vsebujejo HGCL2. Avtor: bitja Silvija. Vir: Pixabay.
Nekatera naravna zdravila, ki jih nadzorujejo ZN, lahko vsebujejo HGCL2. Avtor: bitja Silvija. Vir: Pixabay. Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Mercuric klorid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Lester, s.C. (2010). Obdelava vzorca. Zenkerjev ocetni fiksativ (oranžna). V priročniku kirurške patologije (tretja izdaja). Okrevano od Scientirect.com.
- Clarksson, t.W. (2001). Agenti. Fizikalne in kemijske lastnosti. V priročniku o toksikologiji petic (druga izdaja). Okrevano od Scientirect.com.
- Fretham, s.J.B. et al. (2015). Živo srebro in nevrodegeneracija. Naravna zdravila in zelišča, ki vsebujejo HG. V bioaktivnih prehranskih smeri in prehranskih dopolnilih pri nevrološki in možganski bolezni. Okrevano od Scientirect.com.
- Vitez, s. et al. (2014). Porazdelitev in številčnost vodnih rastlin - človeški vplivi. Kemični polutanti. V referenčni modulaciji v zemeljskih sistemih in okoljskih znanostih. Okrevano od Scientirect.com.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Ciavatta, l. in Grimaldi, m. (1968). Hidroliza živega srebra (II) klorida, HGCL2. Časopis za anorgansko in jedrsko kemijo, letnik 30, številka 2, februar 1968, strani 563-581. Okrevano od Scientirect.com.
- Fundacija Wikimedia (2020). Živo srebro (ii) klorid. Pridobljeno iz.Wikipedija.org.
- « 21 mehiških znanstvenikov in njihovih zgodovinskih prispevkov
- Živo srebro fulminate strukture, lastnosti, pridobivanje, uporabe »

