Kositer klorid (ii)
- 4188
- 689
- Ignacio Barrows
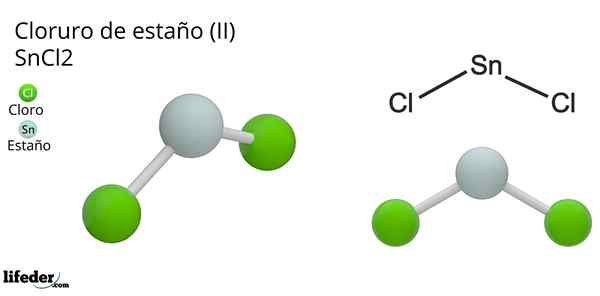
On Kositer klorid (Ii) ali majhen klorid iz kemijske formule sncl2, To je bela in kristalna trdna spojina, produkt kositrne reakcije in koncentrirana raztopina klorovodikove kisline: sn (s) + 2HCl (Conc) => snc2(aq) + h2(g). Proces njegove sinteze (priprave) je sestavljen iz dodajanja kositra, ki reagirajo s kislino.
Po dodajanju kositra se dehidracija in kristalizacija izvedeta, dokler ne dobimo anorganske soli. V tej spojini je kositer izgubil dva elektrona svoje valenčne plasti, da je tvorila povezave z atomi klora.
To je mogoče bolje razumeti, če upoštevamo konfiguracijo Tin Valencia (5s25 strx2strin0strz0), od tega par elektronov, ki zaseda orbitalno px je dodeljen protonom h+, Da bi tvorili diatomsko molekulo vodika. To pomeni, da je to redoksna reakcija.
[TOC]
Lastnosti kositra klorida
 Kositer klorid (ii) dihidrat
Kositer klorid (ii) dihidrat Povezave SNCL2 So ionski ali kovalentni tip? Fizikalne lastnosti tin klorida (ii) zavržejo prvo možnost. Točke fuzije in vrelišča za to spojino sta 247 ° C in 623 ° C, kar kaže na šibke medmolekularne interakcije, skupno dejstvo za kovalentne spojine.
Njegovi kristali so beli, kar pomeni nič absorpcije v vidnem spektru.
Konfiguracija Valencije
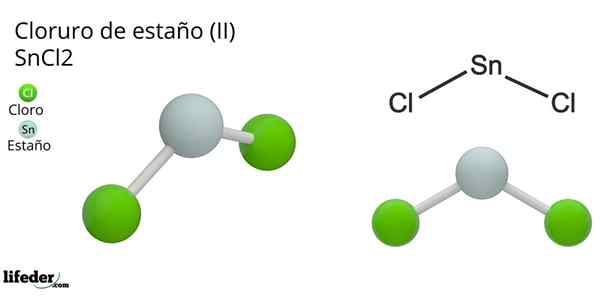
Na zgornji sliki je ponazorjena izolirana kovnica snicka2.
Molekularna geometrija mora biti ravna, ker je hibridizacija osrednjega atoma SP2 (3 SP orbitale2 in čista p orbitala, ki tvori kovalentne vezi), vendar navor brez elektronov zaseda volumen in potisne atome klora navzdol, kar daje molekuli kotni geometriji.
V plinski fazi je ta spojina izolirana, zato ne deluje z drugimi molekuli.
Vam lahko služi: saponifikacijaKot izguba para elektronov v orbitalnem px, Kositer se preoblikuje v sn ion2+ in njegova dobljena elektronska konfiguracija je 5s25 strx0strin0strz0, Z vsemi njegovimi orbitali, ki so na voljo za sprejemanje povezav drugih vrst.
Cl ioni- Koordinirajo s sn ionom2+ Da bi ustvaril kositer klorid. Elektronska konfiguracija kositra v tej soli je 5s25 strx2strin2strz0, Sposobnost sprejeti še en par elektronov v vašem brezplačnem orbitalu Pz.
Na primer, lahko sprejmete drug ion Cl-, tvori trigonalni kompleks ravne geometrije (trikotna osnovna piramida) in negativno obremenjena [sncl3]-.
Reaktivnost
Sncl2 Ima visoko reaktivnost in trend, da se obnaša kot Lewisova kislina (elektronski receptor), da dokonča svoj oktet Valencia.
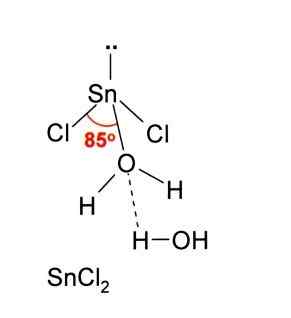
Kot tudi sprejemanje ionskega cl-, Enako velja za vodo, ki "hidrira" atom kositra, ko je molekula vode povezana neposredno s kositrom, druga molekula pa tvori interakcije z vodikovimi mostovi.
Rezultat tega je, da je sncl2 Ni čista, ampak usklajena z vodo v svoji dihidrirani soli: sncl2· 2H2Tudi.
Sncl2 Je zelo topen v vodni in polarni topili, ker je polarna spojina. Vendar njegova topnost v vodi, manjša od masne mase, aktivira reakcijo hidrolize (ruptura molekule vode), da ustvari osnovno in netopno sol:
Sncl2(aq) + h2Ali (l) sn (oh) cl (s) + hcl (aq)
Dvojna puščica kaže, da je vzpostavljeno ravnovesje, favorizirano na levi strani (proti reagentom), če se koncentracije HCl povečajo. Zato rešitve SNCL2 Zaposleni imajo kisli pH, da se izognejo padavinam neželenega solnega produkta hidrolize.
Lahko vam služi: nukleofil: nukleofilni napad, tipi, primeri, nukleofilnostReduktivna aktivnost
Reagira s kisikom zraka, da tvori kositrni klorid (IV) ali klorid je:
6 sncl2(aq) + o2(g) + 2h2Ali (l) => 2Sncl4(aq) + 4Sn (OH) Cl (s)
V tej reakciji tin oksidira, ki tvori povezavo z elektronegativnim atomom kisika in poveča število vezi z atomi klora.
Na splošno elektronegativni atomi halogenov (F, CL, BR in I) stabilizirajo povezave spojin SN (IV) in to dejstvo pojasnjuje, zakaj SNCL2 je reducirajoč sredstvo.
Ko oksidira in izgubi vse svoje valenčne elektrone, sn ion4+ je 5S konfiguracija05 strx0strin0strz0, Biti par elektronov v 5S orbitali, ki jih je najtežje "odvzeti".
Kemična struktura kositrnega klorida
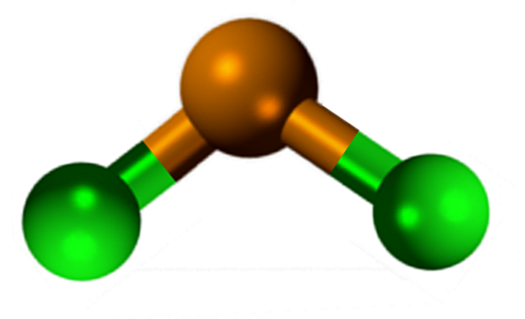 Struktura kositra klorida (ii)
Struktura kositra klorida (ii) Sncl2 Predstavlja kristalno strukturo ortorrombičnega tipa, podobno kot Serruchos vrstice, v katerih so konice zob kloridi.
Vsaka vrstica je veriga sncl3 Oblikovanje mostu CL z drugim Atomom SN (Cl-SN (CL)2-Cl- ···). Dve verigi, skupaj s šibkimi interakcijami tipa SN-CL, predstavljata plast razporeditve, ki se prekriva po drugi plasti in tako naprej, dokler ne določita kristalne trdne snovi.
Prosti elektronski par 5s2 Povzroči popačenje v strukturi, ker zavzema volumen (prostornina elektronskega oblaka).
SN ima lahko koordinacijsko številko, ki je enaka devet, kar je isto kot imeti devet sosedov, pri čemer se s tem nahaja v središču geometrijske figure in CL v točki, poleg drugih CL, ki se nahaja v vsakem od vsakega od kvadratni obrazi prizme.
Vam lahko služi: HydraceTo je lažje opaziti, če se šteje za verigo, na kateri kažejo Sn (temno sive kroglice), in trije CL, povezane s to obliko trikotne dne, medtem ko trije stranke tvorijo zgornjo trikotno streho.
Uporaba/aplikacije
Pri organski sintezi se uporablja kot redukcijsko sredstvo aromatičnih nitro spojin (AR-NO2 à ar-nh2). Ker je njegova kemična struktura laminarna, se v svetu organskih reakcij uporablja v svetu, poleg tega, da je potencialni kandidat za katalitično podporo.
Njegova zmanjšanja lastnost se izkorišča za določitev prisotnosti zlatih spojin, za prekrivanje stekla s srebrnimi ogledali in služenje kot antioksidant.
Tudi v svoji molekularni trigonalni piramidi (: snx3- M+) se uporablja kot osnova Lewis za sintezo ogromnega števila spojin (na primer kompleks PT grozda3Sn8Cldvajset, Kjer je par brez elektronov usklajen s kislino Lewis).
Tveganja
Sncl2 Lahko poškodujete bele krvne celice. Je jedko, dražilno, rakotvorno in ima visoke negativne vplive na vrste, ki naseljujejo morske ekosisteme.
Se lahko razgradi pri visokih temperaturah in sprosti škodljiv plin klora. V stiku z zelo oksidacijskimi sredstvi sproži eksplozivne reakcije.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. V Elementi skupine 14 (Četrta izdaja., str. 329). MC Graw Hill.
- Kemijna knjiga. (2017). Kemijski knjižica: Kemijski knjižica.com
- Pubchem. (2018). Kositer klorid. Pubchem je okreval: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2017). Kositer (ii) klorid. Wikipedia je okrevala: v.Wikipedija.org
- F. Hulliger. (1976). Strukturna kemija faz tipa plasti. P-120,121. D. Reidel Publishing Company.

