Struktura bakrenega klorida (I) (CUCL), lastnosti, uporabe
- 1998
- 436
- Ignacio Barrows
On bakreni klorid (i) To je anorganska spojina, ki jo tvorita baker (Cu) in klor (CL). Njegova kemična formula je cucl. Baker v tej spojini ima Valencia od +1 in klor -1. To je bela kristalna trdna snov, ki ob izpostavljenju dolgo v zraku pridobi zelenkasto obarvanost zaradi oksidacije bakra (i) do bakra (ii).
Obnaša se kot Lewisova kislina, ki potrebuje elektrone drugih spojin, ki so lewis baze, s katerimi tvorijo zapletene ali stabilne adukte. Ena od teh spojin je ogljikov monoksid (CO), zato se sposobnost združevanja med njimi industrijsko uporablja za pridobivanje Co of brezalkoholnih pijač.
 Očiščen bakreni klorid (i) (cucl). Leiem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Očiščen bakreni klorid (i) (cucl). Leiem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Ima optične lastnosti, ki jih je mogoče uporabiti pri lahkih oddajanju polprevodnikov. Poleg tega imajo nanokube CUCL velik potencial za učinkovite energetske naprave.
Uporablja se v umetnosti pirotehnike, ker v stiku s plamenom ustvari modrikasto zeleno luč.
[TOC]
Struktura
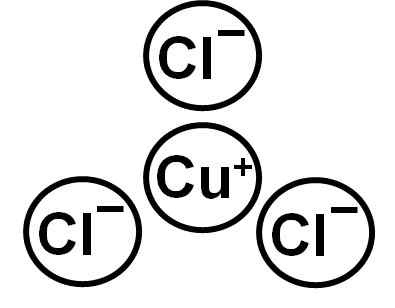
Cucl tvori cuproso cup ion+ in anion klorid Cl-. Elektronska konfiguracija iona Cu+ je:
1s2 2s2 2 p6 3s2 3P6 3D10 4s0
In zato, ker je baker izgubil elektron plasti 4S. Kloridni ion ima konfiguracijo:
1s2 2s2 2 p6 3s2 3P6
Vidimo, da imata oba iona popolne elektronske plasti.
Ta spojina kristalizira s kubično simetrijo. Na spodnji sliki opazimo razporeditev atomov v kristalni enoti. Roza krogle ustrezajo bakreni in zeleni sferi za klor.
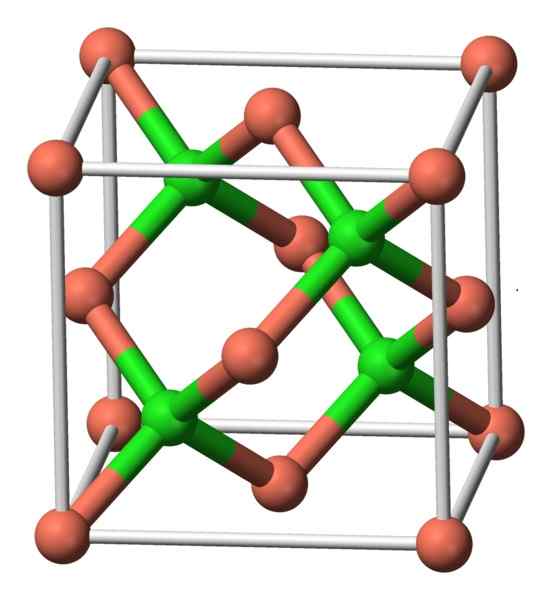 CUCL struktura. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
CUCL struktura. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Nomenklatura
- Bakreni klorid (i)
- Cuprous klorid
- Bakreni monoklorid
Lastnosti
Fizično stanje
Kristalno bela trdna snov, ki je v daljšem zraku z zrakom oksidirana in postane zelena.
Molekularna teža
98,99 g/mol
Tališče
430 ° C
Vrelišče
Približno 1400 ° C.
Gostota
4.137 g/cm3
Topnost
Skoraj netopna v vodi: 0,0047 g/100 g vode pri 20 ° C. Netopna v etanolu (c2H5Oh) in aceton (izberite3(C = o) ch3).
Lahko vam služi: Alilo: Aluična enota, karbokacija, radikalni, primeriKemične lastnosti
V zraku je nestabilno, ker Cu+ se nagiba k oksidiranju Cu2+. Sčasoma je kuprak oksid (CUO), cuprous hidroksid (cuOH) ali kompleksen oksiklorid in sol postan.
 Bakreni klorid (i), ki je bil izpostavljen okolju in delno oksidiran. Cuoh, cuoh in druge spojine lahko vsebujejo. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons.
Bakreni klorid (i), ki je bil izpostavljen okolju in delno oksidiran. Cuoh, cuoh in druge spojine lahko vsebujejo. Benjah-bmm27 / javna domena. Vir: Wikimedia Commons. V vodni raztopini je tudi nestabilen, ker se hkrati pojavi reakcija oksidacije in redukcije, ki tvori kovinski baker in bakreni ion (II):
Cucl → cu0 + Cucl2
Cucl kot Lewis kislina
Ta spojina kemično deluje kot Lewisova kislina, kar pomeni, da je željna za elektrone, zato tvori stabilne adukte z spojinami, ki jim lahko zagotovijo.
Je zelo topen v klorovodiki (HCl), kjer Cl ioni- Se obnašajo kot darovalci elektronov in vrste, kot je cucl2-, Cucl32- in cu2Cl42-, med drugim.
 To je ena od vrst, ki se oblikujejo v raztopinah CUCL v HCl. Avtor: Marilú Stea.
To je ena od vrst, ki se oblikujejo v raztopinah CUCL v HCl. Avtor: Marilú Stea. Vodne raztopine CUCL imajo možnost absorbiranja ogljikovega monoksida (CO). Ta absorpcija se lahko pojavi, kadar so te raztopine tako kisle in nevtralne ali z amonijakom (NH3).
V takšnih rešitvah se ocenjuje, da nastanejo različne vrste, kot je Cu (CO)+, Kukavic)3+, Kukavic)4+, Cucl (co) in [cu (co) cl2]-, ki je odvisno od medija.
Druge lastnosti
Ima elektrooptične značilnosti, nizko optično izgubo v širokem razponu svetlobnega spektra od vidnega do infrardečega, nizkega indeksa loma in konstantnega dielektričnega nizkega.
Pridobivanje
Kovinski klorid (I) lahko dobimo tako, da kovinski baker reagirate neposredno s klorovim plinom pri temperaturi 450-900 ° C. Ta reakcija velja industrijsko.
2 Cu + Cl2 → 2 cucl
Za prenos bakrenega klorida (II) lahko uporabite tudi reducirsko spojino, kot je askorbinska kislina ali žveplov dioksid za bakrov klorid (i). Na primer v primeru SO2, To je oksidirano v žveplovo kislino.
2 cucl2 + SW2 + 2 h2O → 2 cucl + h2SW4 + 2 HCl
Prijave
V procesih za ponovno odkrivanje
Sposobnost rešitev za absorpcijo in inhorber.
Vam lahko služi: turbidimetrijaNa primer, postopek, imenovan Cosorb, uporablja stabiliziran bakreni klorid v obliki zapletene soli z aluminijem (AnyCl4), ki se raztopi v aromatičnem topilu, kot je toluen.
Raztopina absorbira CO plinastega toka, da ga loči od drugih plinov, kot je CO2, N2 in pogl4. Potem se raztopina, bogata z monoksidom, segreva pod znižanim tlakom (to je nižja od atmosferske. Na ta način je namočen plin visoka čistost.
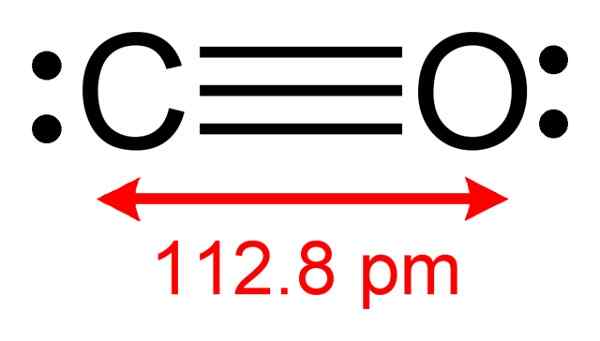 Ogljikova monoksidna struktura, kjer so na voljo elektroni, ki tvorijo kompleksno s CUCL. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
Ogljikova monoksidna struktura, kjer so na voljo elektroni, ki tvorijo kompleksno s CUCL. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Ta postopek vam omogoča, da pridobite čisti CO.
Na katalizi
CUCL se uporablja kot katalizator za različne kemijske reakcije.
Na primer, reakcija elementa Germanio (GE) z vodikovim kloridom (HCl) in etilenom (CH2= Pogl2) lahko storite s to spojino. Služi tudi za sintezo organskih silicijevih spojin in različnih heterocikličnih organskih derivatov žvepla in dušika.
Polifenilenaterski polimer lahko sintetizirate s 4-amipirinom in počepnim katalitičnim sistemom. Ta polimer je zelo koristen za njegove mehanske lastnosti, malo absorpcije vlage, odlično izolacijo električne energije in požarne odpornosti.
Pri pridobivanju organskih bakrenih spojin
Alkenilcupratato spojine lahko pripravimo tako, da reagirate na končni alkiji.
Pri pridobivanju polimerov, združenih s kovinami
Bakreni klorid (I) lahko koordiniramo s polimeri, ki tvorijo kompleksne molekule, ki služijo kot katalizatorji in ki združujejo preprostost heterogenega katalizatorja z pravilnostjo homogenega.
V polprevodnikih
Ta spojina se uporablja pri pridobivanju materiala, ki ga tvori γ-corpu na siliciju.
Ti materiali imajo široko uporabo pri ultravijolični svetlobi, ki oddajajo diode, laserske diode in detektorje svetlobe.
Vam lahko služi: kalijev bromid (KBR): struktura, lastnosti, uporabeV super kartici
Ta izdelek, pridobljen v obliki kubičnih ali nanokubnih nanodelcev.
Superpredre so naprave za shranjevanje energije, ki izstopajo za njihovo veliko gostoto moči, delovanje v operaciji, cikle hitrega nalaganja in praznjenja, dolgotrajno stabilnost in so okolju prijazni.
 Nanocubos cucl bi lahko uporabili v aplikacijah za elektroniko in shranjevanje energije. Avtor: Tide He. Vir: Pixabay.
Nanocubos cucl bi lahko uporabili v aplikacijah za elektroniko in shranjevanje energije. Avtor: Tide He. Vir: Pixabay. Druge aplikacije
Daj.
 Zelena barva nekaterih ognjemetov je lahko posledica smrčanja. Avtor: Hans Braxmeier. Vir: Pixabay.
Zelena barva nekaterih ognjemetov je lahko posledica smrčanja. Avtor: Hans Braxmeier. Vir: Pixabay. Reference
- Milec, j.T. in Neuberger, m. (1972). Klorid cuprous. V: linearni elektrooptični modularni materiali. Springer, Boston, MA. Povezava je bila obnovljena.Springer.com.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Sneeden, r.Str.Do. (1982). Metode absorpcije/desorpcije. V celoviti organometalni kemiji. Zvezek 8. Okrevano od Scientirect.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Chandrashekhar, v.C. et al. (2018). Nedavni napredek neposredne sinteze organometalnih in koordinacijskih spojin. V neposredni sintezi kovinskih kompleksov. Okrevano od Scientirect.com.
- Kyushin, s. (2016). Sinteza organosilicona za gradnjo organosiliconskih grozdov. V učinkovitih metodah za pripravo silicijevih spojin. Okrevano od Scientirect.com.
- Van Koten, g. in noltes, j.G. (1982). Organocopper spojine. V celoviti organometalni kemiji. Zvezek 2. Okrevano od Scientirect.com.
- Danieluk, d. et al. (2009). Optične lastnosti neobremenjenih in kisikovih dopiranih Cucl filmov na silicijevem sublatu. J Mater Sci: Mater Electron (2009) 20: 76-80. Povezava je bila obnovljena.Springer.com.
- Yin, b. et al. (2014). Nanokube, ki se gojijo na bakrenem, ki se gojijo za psevdokapacitorske elektrode. Nano-micro Lett. 6, 340-346 (2014). Povezava je bila obnovljena.Springer.com.
- Kim, k. et al. (2018). Zelo učinkovit aromatični aminski ligand/baker (I) klorid. Polimerji 2018, 10, 350. MDPI se je okreval.com.
- Wikipedia (2020). Baker (i) klorid. Pridobljeno iz.Wikipedija.org.
- « Molarni del, kako se izračuna, primeri, vaje
- Pridobivanje maščob maščob, vrste, sestava, uporabe, koristi »

