Struktura, lastnosti in uporabe jodhidrične kisline (HI)

- 4496
- 109
- Ignacio Barrows
On Iarhidrična kislina Je vodna raztopina vodikovega jodida, za katero je značilna njegova visoka kislost. Definicija, bolj pritrjena na kemično terminologijo in IUPAC.
Vendar pa je za razlikovanje od plinastih molekul vodikovega jodida, HI (G), označeno kot HI (AC). Zaradi tega je v kemičnih enačbah pomembno prepoznati okolje ali fizično fazo, v kateri so bili reagenti in izdelki. Kljub temu so zmede med vodikovim jodidom in iarklorovo kislino običajno pogoste.
 Ioni iarhidrične kisline. Vir: Gabriel Bolívar.
Ioni iarhidrične kisline. Vir: Gabriel Bolívar. Če v njihovi identiteti opazimo zavezane molekule, bodo našli razvpite razlike med HI (G) in HI (AC). V Hi (g) je povezava H-I; Medtem ko so v hi (AC), so pravzaprav par ionov- in h3Tudi+ interakcijo z elektrostom (nadrejena slika).
Po drugi strani je HI (AC) vir HI (g), saj je prvi pripravil raztapljanje drugega v vodi. Zaradi tega, razen če je v kemični enačbi, lahko HI uporabimo tudi za navajanje iarhidrične kisline. HI je močno reducirajoče sredstvo in odličen vir ionov i- V vodnem mediju.
[TOC]
Struktura jodhidrične kisline
Yodhidric kislina, kot je razloženo, je sestavljena iz raztopine HI v vodi. HI molekule, ki so v vodi, se popolnoma ločijo (močan elektrolit), ki izvira- in h3Tudi+. Ta disociacija je lahko predstavljena z naslednjo kemijsko enačbo:
Živjo (g) + h2Ali (l) => i-(Ac) + h3Tudi+(AC)
Kaj bi bilo enakovredno, če bi napisano kot:
Živjo (g) + h2Ali (l) => hi (ac)
Vendar HI (AC) sploh ne razkrije, kaj se je zgodilo z plinastimi hi molekulami; To samo kaže, da so v vodnem mediju.
Zato je resnična struktura HI (AC) sestavljena iz ionov i- in h3Tudi+ Obkrožene z molekulami vode, ki jih vlažijo; Bolj ko koncentriramo iarhidrično kislino, nižje je število molekul vode brez protona.
Vam lahko služi: Boyle LawKomercialno je v resnici koncentracija HI 48 do 57% v vodi; Bolj koncentrirano bi bilo enakovredno, če bi kislina preveč kadila (in še bolj nevarna).
Na sliki je razvidno, da anion i- Predstavljen je z vijolično kroglo in h3Tudi+ Z belimi sferami in rdečo, za kisik. Kation h3Tudi+ Predstavlja molekularno trigonalno piramido (vidno iz višje ravnine na sliki).
Lastnosti
Fizični opis
Brezbarvna tekočina; Lahko pa pokažete rumenkaste in rjave tone, če ste v neposrednem stiku s kisikom. To je zato, ker ioni I- Na koncu oksidalizirajo molekularni jod, i2. Če je veliko jaz2, Več kot verjetno je, da se bo oblikoval triaduro anion, i3-, ki obarva raztopino kot rjava.
Molekularna masa
127,91 g/mol.
Vonj
Hektar.
Gostota
Gostota je 1,70 g/ml za 57%HI rešitev; Ker se gostote razlikujejo glede na različne koncentracije HI. Ta koncentracija tvori azeotropsko (destilirano je kot ena sama snov in ne kot mešanica), katere relativna stabilnost je mogoče dolgovati nad njeno komercializacijo nad drugimi rešitvami.
Vrelišče
57% Hi azeotrop zavre pri 127 ° C pri tlaku 1,03 bara (prehodite na ATM).
PKA
-1,78.
Kislost
Je izjemno močna kislina, toliko, da je jedla za vse kovine in tkiva; tudi za gumarje.
To je zato, ker je povezava H-I zelo šibka in je med ionizacijo vode zlahka prekinjena. Poleg tega vodikov mostovi i- - Hoh2+ So šibki, zato ni nič, kar bi motilo H3Tudi+ reagirati z drugimi spojinami; to je, h3Tudi+ ima "brezplačno", kot sem- to ne pritegne preveč njegovega protiutiona.
Vam lahko služi: piknometerZmanjšanje sredstva
HI je močno reducirajoče sredstvo, katerega glavni reakcijski izdelek je jaz2.
Nomenklatura
Nomenklatura iarhidrične kisline izhaja iz dejstva, da jod "deluje" z enim samim oksidacijskim stanjem: -1. In poleg tega ime kaže, da ima v svoji strukturni formuli vodo [i-] [H3Tudi+]. To je edino ime, saj ni čista spojina, ampak rešitev.
Prijave
Vir joda v organski in anorganski sintezi
HI je odličen vir ionov i- za anorgansko in organsko sintezo in je tudi močno reducirajoče sredstvo. Na primer, njegovo 57 -odstotno vodno raztapljanje se uporablja za sintezo alkil jodidov (na primer CHO3Pogl2I) iz primarnih alkoholov. Prav tako lahko skupina OH v strukturi nadomesti z i.
Zmanjšanje sredstva
Yodhidric kislina je bila uporabljena za zmanjšanje na primer ogljikove hidrate. Če se segreva glukoza, raztopljena v tej kislini, bo izgubila vse svoje skupine OH in kot izdelek dobila ogljikovodik N-heksana.
Prav tako se uporablja za zmanjšanje funkcionalnih skupin grafenskih listov, tako da jih je mogoče funkcionalizirati za elektronske naprave.
Proces Cativa
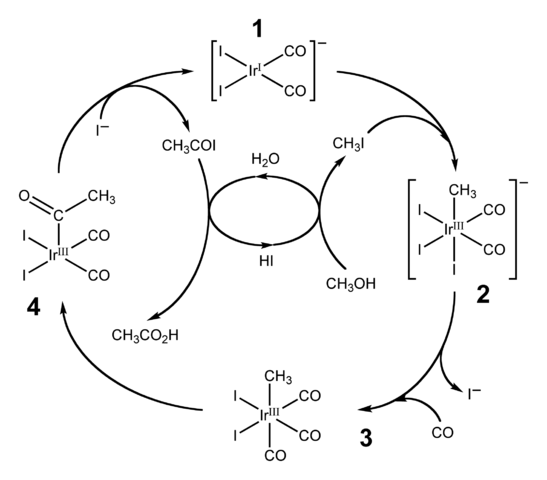 Diagram katalitičnega cikla za postopek Cativa. Vir: Ben Mills [javna domena].HI se uporablja tudi za industrijsko proizvodnjo ocetne kisline s postopkom Cativa. To je sestavljeno iz katalitičnega cikla, v katerem pride do karbonilacije metanola; to pomeni za molekulo ch3Oh, uvedena je karbonilna skupina, c = o, za preoblikovanje v cho kislino3COOH.
Diagram katalitičnega cikla za postopek Cativa. Vir: Ben Mills [javna domena].HI se uporablja tudi za industrijsko proizvodnjo ocetne kisline s postopkom Cativa. To je sestavljeno iz katalitičnega cikla, v katerem pride do karbonilacije metanola; to pomeni za molekulo ch3Oh, uvedena je karbonilna skupina, c = o, za preoblikovanje v cho kislino3COOH.
Koraki
Postopek se začne (1) s kompleksom organo-iridij [IR (CO)2Yo2]-, kvadratne ravne geometrije. Ta spojina "sprejema" metil jodid, ch3I, produkt zakisitve Cho3Oh s 57% zdravo. Voda se pojavi tudi v tej reakciji in po zaslugi tega dobimo ocetno kislino na koncu, hkrati pa omogočimo, da se HI opomore v zadnjem koraku.
Vam lahko služi: koloidV tem koraku obe skupini -CH3 Ko se -i pridruži kovinskemu centru Ididio (2), tvori oktaedrski kompleks z fasetom, sestavljenim iz treh ligandov in. Eden od Yodos se na koncu nadomesti z molekulo ogljikovega monoksida, CO; In zdaj (3) ima oktaedrski kompleks faseta, sestavljena iz treh co -ligand.
Potem pride do preureditve: skupina -ch3 Iz IR se "sprosti" in se pridruži sosednji (4), da tvori acetilno skupino, -coch3. Ta skupina je izdana iz kompleksa Iridido, da se poveže z jodidnimi ioni in daje Cho3Coi, acetil jodid. Tu je obnovljen Iridium katalizator, pripravljen za sodelovanje v drugem katalitičnem ciklu.
Končno, Cho3Coi trpi za zamenjavo i- Za h molekulo2Ali, čigar mehanizem se konča z sproščanjem HI in ocetne kisline.
Nedovoljena sinteza
 Reakcija redukcije efedrina z rdečim fosforičnim in fosforjem do metafetamina. Vir: metamfetamin_from_ephedrine_with_hi_ru.SVG: izpeljan Ring0 Trabajo: Materialist (govorjenje) [javna domena].Yodhidric kislina je bila uporabljena za sintezo psihotropne snovi, ki izkorišča svojo visoko reduktivno moč. Na primer, lahko zmanjšate efedrin (zdravilo za zdravljenje astme) v prisotnosti rdečega fosforja, na metamfetamin (nadrejena slika).
Reakcija redukcije efedrina z rdečim fosforičnim in fosforjem do metafetamina. Vir: metamfetamin_from_ephedrine_with_hi_ru.SVG: izpeljan Ring0 Trabajo: Materialist (govorjenje) [javna domena].Yodhidric kislina je bila uporabljena za sintezo psihotropne snovi, ki izkorišča svojo visoko reduktivno moč. Na primer, lahko zmanjšate efedrin (zdravilo za zdravljenje astme) v prisotnosti rdečega fosforja, na metamfetamin (nadrejena slika).
Vidimo, da zamenjava skupine OH s strani I, ki ji sledi druga zamenjava za h.
Reference
- Wikipedija. (2019). Hidroidna kislina. Pridobljeno iz: v.Wikipedija.org
- Andrews, Natalie. (24. aprila 2017). Uporaba hidriodne kisline. Znanstvenik. Okrevano od: Znanstvenik.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hidriodna kislina. Okreval od: alfa.com
- Nacionalni center za informacije o biotehnologiji. (2019). Hidriodna kislina. Baza podatkov Pubchem., Cid = 24841. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Steven a. Hardinger. (2017). Ilustrirani slovar organske kemije: hidroidna kislina. Okrevano od: kem.UCLA.Edu
- Reusch William. (05. maj 2013). Ogljikovi hidrati. Okrevano od: 2.Kemija.MSU.Edu
- V Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). REDENT TRAPHENI OKID s kemično grafitizacijo. Doi: 10.1038/NCOMMS1067.
- « Memoristične učne značilnosti, vrste in primeri
- Značilnosti, vrste, prednosti in stopnje bioprocesov »

