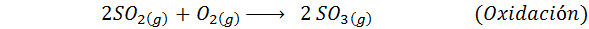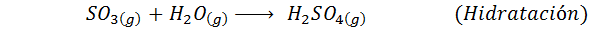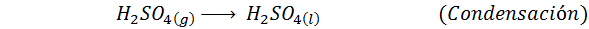Žveplova kislina (H2SO4)

- 4000
- 1127
- Miguel Gutmann DVM
Pojasnjujemo, kaj je žveplova kislina, njena kemična struktura, lastnosti, kako se pridobiva, uporaba in tveganja za uporabo so
 Čolni z žveplovo kislino (H2SO4)
Čolni z žveplovo kislino (H2SO4) Kaj je žveplova kislina?
On žveplova kislina, Imenuje se tudi vodikov sulfat in vitriolsko olje3) in voda. Njegova molekularna formula je h2SW4 In je daleč najbolj proizvedena in uporabljena mineralna kislina.
To je močna in zelo jedja mineralna kislina, ki jo je zmešana z vodo, tako da jo je mogoče pripraviti v obliki raztopin skoraj vsake koncentracije med 0 in okoli 18 mollov.
Visoke količine proizvodnje in porabe te spojine so posledica številnih aplikacij v panogah, ki so raznolike kot kmetijstvo, petrokemična industrija, v organski in anorganski sintezi in pri čiščenju odpadne vode, če naštejemo le nekaj le nekaj nekaterih le nekaj.
Struktura žveplove kisline
Žveplova kislina tvori centralni atom žvepla z Valencijo VI, ki je obdana s 4 atomi kisika, od katerih sta dva povezana z vodikovimi atomi. Njegova struktura Lewis je predstavljena spodaj:
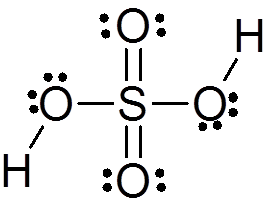
Kot vidite, je žveplo v tej spojini obkrožen z 12 elektroni (6 parov), zato predstavlja eno od izjem pravila okteta.
Ker je obkrožena s 4 atomi, teorija odbojnosti elektronskih parov Valencije (Trepev) napoveduje, da mora ta spojina prevzeti približno tetraedrsko geometrijo, ki je prikazana na naslednji sliki:
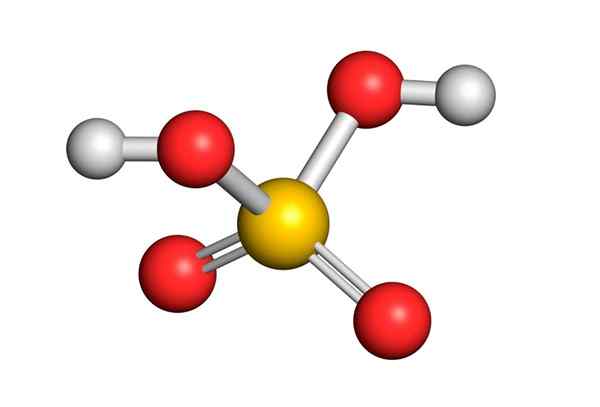
Zaradi visoke elektronegativnosti kisika in različnih resonančnih struktur, ki jih lahko ima žveplova kislina.
Lastnosti žveplove kisline
Zaradi svoje strukture ima žveplova kislina naslednje fizikalne in kemijske lastnosti:
Lahko vam služi: epoksid: nomenklatura, pridobivanje, aplikacije, primeriFizične lastnosti
- Čista žveplova kislina je brezbarvna in toaletna tekočina, ki ima gostoto 18302 g/ml.
- Njegova tališče je 10,31 ° C in vrelo je 337 ° C, čeprav se pri tej temperaturi razgradi za proizvodnjo vode in žveplovega anhidrida (imenovan tudi žveplov trioksid).
- Popolnoma je mešana z vodo, tako da lahko rešite rešitve s katero koli koncentracijo. Vendar so raztopine z več kot 98,3% mase te kisline nestabilne in kislina se razgradi, dokler se njegova koncentracija ne zmanjša na 98,3%. Ta raztopina je stabilna in je znana kot koncentrirana žveplova kislina.
- V svojem čistem ali koncentriranem stanju je bolj viskozna tekočina kot voda.
Kemične lastnosti
- Čista žveplova kislina je močno oksidacijska in jedka snov. Ima sposobnost oksidiranja, dehidrate in sulfonarja do najrazličnejših organskih spojin in karbonizira druge.
- To je močna diprotična kislina, ki popolnoma izgubi svoj prvi proton z raztapljanjem v vodi in tako postane konjugirana baza, bisulfatni ion (HSO4-). Ta ion je tudi kislina, čeprav šibkejša od prvotne kisline.
- Vodne raztopine žveplove kisline so močno kisle in lahko raztopijo številne kovine, kar ustvarja plinasti vodik. Lahko tudi popolnoma nevtralizirajo močne podlage.
- Silovito reagira z mnogimi alkoholi in vodo, sprošča velike količine toplote v postopku.
Kako dobimo žveplovo kislino?
Trije najbolj znani procesi proizvodnje žveplove kisline so: postopek kontakta, postopek mokre žveplove kisline in postopek svinčenih kamer.
1. Sinteza žveplove kisline s kontaktnim postopkom
To je danes najbolj uporabljena metoda za proizvodnjo žveplove kisline. Postopek je sestavljen iz 5 korakov, v katerih osnovni žveplo postane žveplov dioksid (tako2), nato žveplov trioksid (tako3), disulfrinska kislina (h2S2Tudi7) in končno v žveplovi kislini. Vključene reakcije so:
Vam lahko služi: kaj je varnostni romb in za kaj je?
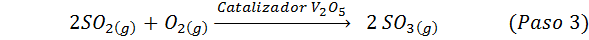


Drugi korak postopka je preprosto sestavljen iz čiščenja žveplovega dioksida, preden se pretvori v žveplovi ali žveplovi anhidridni trioksid. Reakcija tretjega koraka se pojavi, ko plinski žveplov dioksid pride v stik s trdnim vanadijevim pentaoksidom (V2Tudi5) In zato se metoda imenuje kontaktni postopek.
2. Sinteza žveplove kisline s pomočjo mokrega procesa
Ta postopek je bil zasnovan za čiščenje emisijskih plinov najrazličnejših kemičnih industrij in rastlin. Stranski produkt tega čiščenja je komercialna žveplova kislina poleg tople vodne pare, ki jo je mogoče ponovno uporabiti v prvotnem industrijskem procesu.
V primeru mokrega procesa so reakcije večinoma. Pomembne reakcije, ki se pojavijo na vsaki stopnji, so:
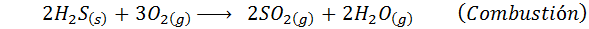
3. Sinteza žveplove kisline s postopkom svinčenih kamer
To je starodavna metoda za proizvodnjo žveplove kisline, ki se danes uporablja zelo malo. Postopek je bil kuriti osnovni žveplo v prisotnosti zračnega kisika v lesenih komorah, prevlečenih s svincem.
Po tem izgorevanju žveplovi dioksid nato reagira z dušikovimi oksidi, ki nastanejo z razgradnjo natrijevega nitrata ali z drugimi sredstvi. Na koncu smo po vrsti dodatnih reakcij dobili žveplovo kislino.
Vam lahko postreže: Flask Flat BackgroundSkupne aplikacije
- Glavna uporaba žveplove kisline je kot vir žvepla v obliki sulfatov pri proizvodnji gnojil. Pravzaprav je v ta namen namenjenih približno 60% žveplove kisline, proizvedene na svetu.
- V kemični industriji se uporablja za sintezo detergentov, pigmentov, katalizatorjev za petrokemično industrijo in pri predelavi mineralov za pridobivanje različnih kovin.
- Končno je žveplova kislina elektrolit, ki se uporablja v svinčevih baterijah, ki se uporabljajo v večini avtomobilov.
Tveganja, povezana z žveplovo kislino
Zaradi kemijskih lastnosti je lahko žveplova kislina zelo nevarna tako za človeka kot za živali kot na okolje na splošno. To je nekaj tveganj, povezanih s to kemikalijo:
- Njegove korozivne in dehidrirajoče značilnosti povzročijo čisto kislino, če pride v stik s kožo.
- Po drugi strani reakcija vodnih raztopin žveplove kisline s kovinami ustvari plinasti vodik, ki je gorivo in eksplozivna snov.
- Sama žveplova kislina ne trpi reakcije izgorevanja, ampak, ker je močan oksidant, spodbuja zgorevanje drugih snovi, ki deluje kot nekakšen katalizator, zato predstavlja veliko požarno tveganje.
- Poleg tega, ko je izpostavljen ognju, ga lahko razdelite na strupene pline in ustvarite hlape žveplove kisline, ki zlahka uničijo dihalne poti.
Zaradi teh razlogov in še več je žveplova kislina snov, ki jo je treba skrbno ravnati.