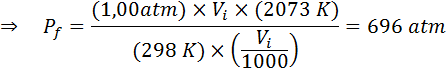Zakon o splošnih plinih

- 2617
- 143
- Dexter Koch
Kaj je splošni zakon o plinu?
The Zakon o splošnih plinih, Včasih se imenuje tudi kombinirani zakon plinov, to je kombinacija Boyleovih zakonov, Charlesa in Gay-Lussac. To je zakon, ki opisuje razmerje med tlakom, temperaturo in prostornino fiksne količine idealnega plina.
V izjavi tega zakona pravi:
"Če je število molov plina konstantno, razmerje med tlakom in temperaturnim izdelkom ostane konstantno."
V matematični obliki se splošni zakon plinov izraža na naslednji način:
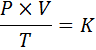
Kadar P predstavlja tlak plina, v njene prostornine, t absolutne temperature in k je konstanta sorazmernosti, katere vrednost je odvisna od količine sedanjega plina in enot, v katerih so izražene druge spremenljivke.
Alternativne oblike splošnega zakona o plinu
Kot zakon o sorazmernosti
Nadomestni način za določanje splošnega zakona plinov je v obliki sorazmernosti:
"Za katero koli fiksno količino plina je produkt njegovega tlaka in volumna neposredno sorazmerna s temperaturo".
To pomeni da:
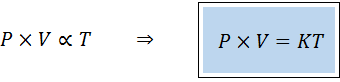
To je enakovredno množitvi obeh članov prve enačbe s temperaturo.
Razmerje med začetnim in končnim stanjem
Tako kot zakoni Boyle, Charles in Gay-Lussac se tudi splošni zakon o plinu lahko izrazi kot razmerje med prvotno državo in končno stanje plina, ki se spremeni.
Za razliko od prejšnjih zakonov ni nujno, da nobena od treh spremenljivk ne ostane konstantna, le število molov. To pomeni, da bo razmerje PXV/T v začetnem stanju enako, Yo, In v končnem stanju, F. Z drugimi besedami, splošni zakon o plinu je mogoče izraziti tudi matematično kot:
Lahko vam služi: píchric kislina: kaj je, struktura, sinteza, lastnosti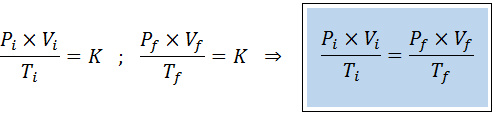
Izpeljava formule splošnega zakona o plinu
Kot že omenjeno, splošni zakon o plinu izvira iz kombinacije zakonov Boyle, Charlesa in Gay-Lussac. Ti zakoni so predstavljeni spodaj:
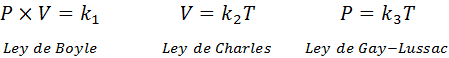
Če iz vsakega od teh zakonov razjasnimo konstanto k, In potem jih pomnožimo med seboj, dobimo:
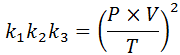
Zdaj, ko v obeh članih prevzamejo kvadratni koren, se pridobi splošni zakon o plinu:
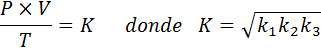
Splošni zakon plinov vs. Zakon idealnih plinov
Zakon o splošnih plinih z zakonom o idealnih plinih ne bi smeli zamenjati. Kljub temu, da sta dva zelo podobna in tudi tesno povezana zakona, splošni zakon o plinu združuje le zakone Boyle, Charles in Gay-Lussac.
Zakon o idealnih plinih dodaja načelo Avogadro, po katerem "Enake količine različnih plinov, izmerjenih v enakih temperaturnih in tlačnih pogojih, vsebujejo enako število delcev. ".
Posledica tega, da zakon o temperaturi, prostornini in tlaku, zakon idealnega plina omogoča tudi te spremenljivke, ki so povezane s številom delcev ali molov plina, zato predstavlja državno enačbo statusa stanja Idealni plini.
V naslednjih enačbah je razlika med tema dvema zakonoma lažje opaziti:

Upoštevajte, da je glavna razlika med obema zakonoma v tem, da idealni zakon o gasiranju vključuje n, ki predstavlja število molov in tudi namesto konstante K, ima Konstanta r, ki je konstanta idealnih plinov.
Vam lahko služi: terpenosLahko bi rekli, da je zakon o idealnih plinih bolj splošen od splošnega zakona o plinu, saj ga je mogoče uporabiti za katero koli količino plina v katerem koli nizu tlakov, temperature in volumna. Po drugi strani pa uporaba splošnega zakona o plinu zahteva, da količina plina ostane konstantna.
Primeri uporabe splošnega zakona o plinu
Spodaj je nekaj primerov značilnih težav, pri katerih je mogoče uporabiti splošni zakon o plinu:
Primer 1: Podvodni zračni mehurček
Recimo, da potapljač, ki je na globini 20 m pod vodo, kjer je tlak 3,00 atm, temperatura pa 15 ° C sprosti dih zraka in eden od mehurčkov ima začetno prostornino 100 cm3.
Določite prostornino zračnega mehurčka, ko doseže površino, ki je v standardnih temperaturnih in tlačnih pogojih, ob predpostavki, da se količina zraka v mehurčku ne spreminja, ko se dviga.
Rešitev
Najprej moramo izvleči vse podatke iz izjave. Razume se, da obstajata dve različni državi za plin, en začetni in en konec, zato podatke ločimo v dve skupini. Prav tako je treba pretvoriti temperature pri absolutni temperaturi:

Ker težava določa, da se količine plina (zraka) ne spreminja, lahko uporabimo splošni zakon o plinu, iz katerega lahko očistimo končni obseg:
Vam lahko služi: rodio: zgodovina, lastnosti, struktura, uporabe, tveganje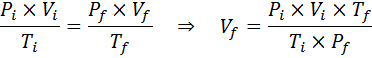
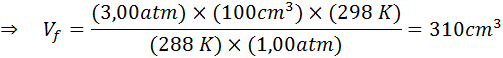
Zato zračni mehurček doseže prostornino 310 cm3 Ko dosežete površino.
Primer 2: Visok tlak
Koliko bo tlak idealnega plina, ki je pri temperaturi okolice 25 ° C in tlaku 1,00 atm in stisnil tisoč njene volumne hkrati ogrevanje do 1800 ° C v zaprti posodi?
Rešitev
Kot prej začnemo z izvlecitvijo podatkov:

Kot pravi, da se postopek izvaja v zaprti posodi, se količina plina ne spremeni, zato je mogoče uporabiti splošni zakon o plinu: