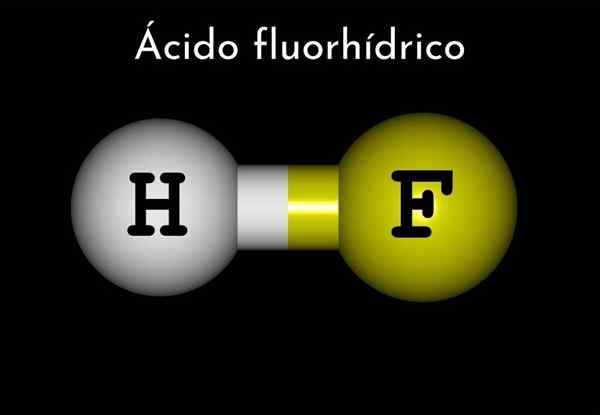
Fluorhorična kislina (HF)
- 4497
- 486
- Mr. Shane Larkin
Kaj je fluorhorična kislina?
On kislinska kislina (HF)Je vodna raztopina, v kateri se raztopi vodikov fluorid. To kislino dobimo predvsem iz reakcije žveplove kisline, koncentrirane s fluoritnim mineralom (CAF2). Mineral se razgradi z delovanjem preostale kisline in voda raztopi vodikov fluoridni plini.
Iz te iste kisle vode lahko čisti izdelek destiliramo, to je anhidrid vodikov fluorid. Odvisno od količine raztopljenega plina dobimo različne koncentracije in zato več razpoložljivih produktov fluorhorhororske kisline na trgu.
Pri koncentraciji manj kot 40 %ima nerazločljiv kristalni videz vode, pri višjih koncentracijah. Fluorhorska kislina je znana kot ena najbolj agresivnih in najbolj nevarnih kemikalij.
Lahko "jeste" skoraj vsak material, s katerim imate stik: od stekla, keramike in kovin, do kamnin in betona. V katerem je posoda shranjena? V plastičnih steklenicah inertni sintetični polimeri na vaše delovanje.
Formula
Formula vodikovega fluorida je HF, vendar je fluorhorična kislina predstavljena v vodnem mediju HF (AC), da se razlikuje od prvega.
Tako lahko fluorhorično kislino obravnavamo kot hidratni vodikov fluorid in to je anhidrid.
Struktura kislinska kislina
 3D model fluorhidrične kisline
3D model fluorhidrične kisline Vsa kislina v vodi lahko ustvari ione v ravnotežnem reakciji. V primeru fluoridne kisline ocenjujemo, da je v raztopini par Hones H3Tudi+ in f-.
Anion f- Verjetno tvorijo zelo močan vodikov most z enim od kationskih vodikov (F-H-O+-H2). To pojasnjuje, zakaj je fluorhorhorinska kislina šibka Bree kislina (darovalec protonov, h+), kljub visoki in nevarni reaktivnosti; torej v vodi ne sprošča toliko h+ v primerjavi z drugimi kislinami (HCl, HBR ali HI).
Lahko vam služi: koliko kredanskih elektronov ima ogljik?Vendar pa so v koncentriranih fluorhorhororhorornih kislinah med molekulami vodikovega fluorida dovolj učinkovite, da lahko pobegnejo v plinski fazi.
To pomeni, da lahko znotraj vode komunicirajo, kot da bi bili v tekočem anhidridu in tako tvorijo vodikove mostove med njimi. Te vodikove mostove lahko asimiliramo kot skoraj linearne verige (H-F-H-F-F-…), obdane z vodo.

Na vrhunski sliki je neharen navor elektronov, usmerjen v nasprotno smer povezave (H-F :) sodeluje z drugo molekulo HF, da sestavi verigo.
Lastnosti kislinska kislina
Ker je vodna raztopina fluorhorhororne kisline, so njegove lastnosti odvisne od koncentracije anhidrida, raztopljenega v vodi. HF je zelo topen v vodi in je higroskopski, saj lahko proizvaja različne raztopine: od zelo koncentriranih (kajenje in z rumenimi toni) do zelo razredčenih.
Ko se njegova koncentracija zmanjšuje, HF (AC) sprejme lastnosti, bolj podobne čisti vodi kot anhidrid. Vendar so H-F-H vodikovi mostovi močnejši od tistih v vodi, h2Oh oh.
Oba soobstajata v harmoniji v rešitvah, dvigujeta vrelišča (do 105 ° C). Prav tako se gostote povečujejo, ko se raztopi več hinhidrida. Od ostalih imajo vse rešitve HF (AC) močne in razdražljive vonjave in so brezbarvne.
Reaktivnost
Kaj je torej jedko vedenje fluorhorične kisline? Odgovor je v povezavi s H-F in v sposobnosti fluorovega atoma, da tvori zelo stabilne kovalentne povezave.
Ker je fluorid zelo majhen in elektronegativni atom, je močna Lewisova kislina. To pomeni, da se loči od vodika do povezav, ki ponujajo več elektronov do nizkih stroškov energije. Na primer, te vrste so lahko kovine, kot je silicij, prisoten v steklu.
Lahko vam služi: jedrska kemija: zgodovina, področje študija, območja, aplikacijeSio2 + 4 hf → sif4(g) + 2 h2Tudi
Sio2 + 6 HF → H2Sif6 + 2 h2Tudi
Če je disociacijska energija povezave H-F visoka (574 kJ/mol), zakaj je v reakcijah prekinjena? Odgovor ima kinetične, strukturne in energetske nianse. Na splošno je manj reaktiven rezultat, bolj je naklonjen njenemu oblikovanju.
Kaj se zgodi s F- v vodi? V koncentriranih raztopinah fluorhorične kisline lahko druga molekula HF tvori vodikov most s F- para [h3Tudi+F-].
To ima za posledico nastajanje defluoridnega iona [FHF]-, kar je izredno kislo. Zato je ves fizični stik s tem izjemno škodljiv. Najmanjša izpostavljenost lahko sproži neskončnost škode agenciji.
Obstaja veliko varnostnih standardov in protokolov za ustrezno upravljanje, zato se izogibajo morebitnim nesrečam za tiste, ki delujejo s to kislino.
Uporaba/uporaba fluorhorhoric kisline
Gre za spojino s številnimi aplikacijami v industriji, v raziskavah in v delu potrošnikov:
- Fluorhorska kislina ustvarja organske derivate, ki sodelujejo v procesu čiščenja aluminija.
- Uporablja se pri ločitvi izotopov urana, kot v primeru uranovega heksafluoruro (UF6). Uporablja se tudi pri ekstrakciji, predelavi in rafiniranju kovin, kamnin in olj, ki se uporabljajo tudi za inhibicijo rasti plesni in odstranjevanja plesni.
- Korozivne kislinske lastnosti so bile uporabljene za izrezljanje in snemanje kristalov, zlasti zmrzali, s tehniko jedkanja.
- Uporablja se pri izdelavi silikonskih polprevodnikov z večkratno uporabo pri razvoju računalništva in računalništva, odgovorni za človeški razvoj.
- Uporablja se v avtomobilski industriji kot čistilec, ki se uporablja kot odstranjevalec plesni v keramiki.
- Poleg tega, da v nekaterih kemičnih reakcijah služi kot posrednik, se fluorhorična kislina uporablja tudi pri nekaterih ionskih izmenjevanjih, ki sodelujejo pri čiščenju bolj zapletenih kovin in snovi.
- Sodelujte pri predelavi olja in njegovih derivatov, kar je omogočilo pridobitev topil za uporabo pri proizvodnji izdelkov za čiščenje in odpravo maščob.
- Uporablja se pri ustvarjanju povzročiteljev za furnir in površinsko obdelavo.
- Potrošniki uporabljajo številne izdelke, v katerih je fluorhorična kislina sodelovala pri izdelavi; Na primer, nekatere potrebne za nego avtomobilov, čiščenje izdelkov za pohištvo, električne in elektronske komponente ter goriva, med drugimi izdelki.
Reference
- Pubchem. (2018). Kislinska kislina. Pridobljeno 3. aprila 2018, od: Pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Kat dan. (16. april 2013). Kislina, ki resnično poje skozi vse. Pridobljeno 3. aprila 2018 iz: Chronicleflask.com
- Wikipedija. (28. marec 2018). Kislinska kislina. Pridobljeno 3. aprila 2018, od: In.Wikipedija.org.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja., str. 129, 207-249, 349, 407). MC Graw Hill.
- Kislinska kislina. Mišica. Medicinska univerza v Južni Karolini. Pridobljeno 3. aprila 2018, od: AcademicDeptarts.Mišica.Edu