Ciklobutanska struktura, lastnosti, uporabe in sinteza
- 3514
- 666
- Ricky Dach
On Ciklobutan To je ogljikovodik, ki ga sestavlja štiriokarbonski ciklokano, katerega molekularna formula je c4H8. Lahko se imenujete tudi tetrametilen, če upoštevamo, da obstajajo štiri enote ZN2 ki sestavljajo prstan s kvadratno geometrijo, čeprav je ime ciklobutana bolj sprejeto in znano.
Pri sobni temperaturi je brezbarven, vnetljiv plin, ki gori s svetlim plamenom. Njegova najbolj primitivna uporaba je kot vir toplote, tako da jo kuri; Vendar njegova strukturna baza (kvadrat) zajema globoke biološke in kemične vidike in na določen način sodeluje z lastnostmi omenjenih spojin.
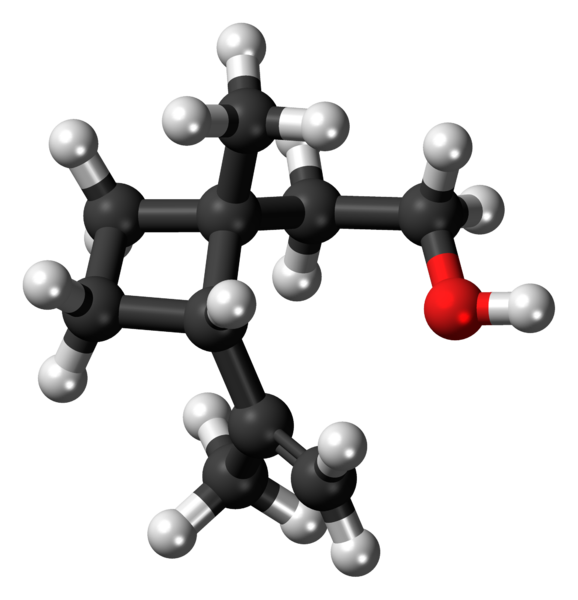
 Ciklobutanska molekula v napeti konformaciji. Vir: Jynto [CC0].
Ciklobutanska molekula v napeti konformaciji. Vir: Jynto [CC0]. Na zgornji sliki je prikazana molekula ciklobutana s kvadratno strukturo. V naslednjem razdelku bo razloženo, zakaj je ta konformacija nestabilna, saj so njene povezave napete.
Po ciklopropom je najbolj nestabilen cikloalkan, saj manjša velikost obroča, bolj reaktivna bo. V skladu s tem je ciklobutan bolj nestabilen kot cikli Pentan in Hexano. Vendar je v svojih izpeljanih za radovedno priča jedro ali kvadratno srce, ki je, kot bo videti, dinamično.
[TOC]
Ciklobutanska struktura
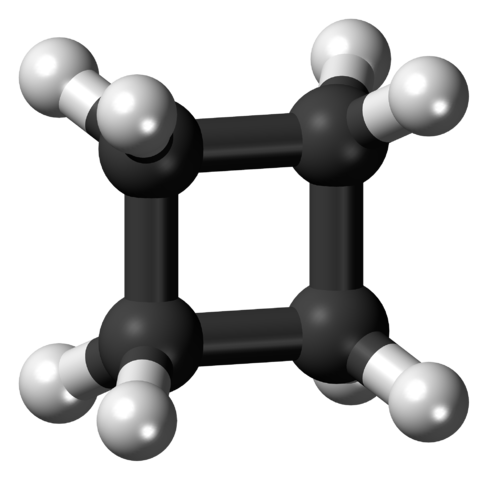
Na prvi sliki je bila struktura ciklobutana obravnavana kot preprost ogljik in hidrogeniran kvadrat. Vendar pa na tem popolnem kvadratu orbitale trpijo hudo iztegnitev svojih prvotnih kotov: ločeni so s kotom 90 ° v primerjavi z 109,5 ° za ogljikov atom s spa hibridizacijo sp3 (kotna napetost).
Mete avtomobila ogljika3 So tetraedrali, za nekatere tetraedre pa bi bilo težko upogniti obe svoji orbitali, da bi ustvarili kot 90 °; Toda še bolj bi bilo za ogljikove s hibridizacijami SP2 (120 °) in SP (180 °) preusmerite svoje prvotne kote. Zaradi tega ima ciklobutan atome ogljika3 v bistvu.
Vam lahko služi: sekundarni alkohol: kaj je, struktura, lastnosti, uporabeTudi vodikovi atomi so zelo blizu drug drugemu, zasenčeni v vesolje. To ima za posledico povečanje stericne ovire, kar oslabi domnevni kvadrat zaradi njegove visoke torzijske napetosti.
Zato kotne in torzijske napetosti (zaprte v izraz „obročasta napetost“) naredijo to konformacijo nestabilno v normalnih pogojih.
Ciklobutan.
Metulji ali nagubane konformacije
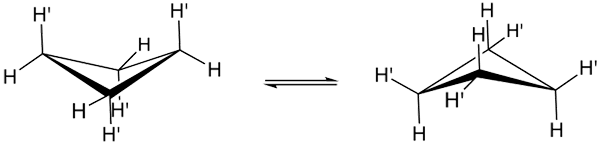 Ciklobutanske skladnosti. Vir: Smokefoot.
Ciklobutanske skladnosti. Vir: Smokefoot. Resnične skladnosti ciklobutana so prikazane zgoraj. V njih se kotne in torzijske napetosti zmanjšujejo; Ker, kot je razvidno, niso vsi vodikovi atomi zasenčeni. Vendar pa obstajajo stroški energije: kot njegovih povezav se še poslabša, torej nizka od 90 do 88 °.
Upoštevajte, da ga je mogoče primerjati z metuljem, katerega trikotna krila tvorijo trije ogljikovi atomi; in četrti, nameščen pod kotom 25 ° glede na vsako krilo. Dvojne puščice poudarjajo, da obstaja ravnovesje med obema konformi. Kot da metulj spusti in se povzpne na krila.
V tistih, ki izhajajo iz ciklobutana, bi bilo pričakovati, da bo ta tresenje veliko bolj počasen in prostorsko preprečen.
Medmolekularne interakcije
Recimo, da nekaj trenutkov na kvadratih pozabite in jih na mestu zamenjate s gaziranimi metulji. Ste v njihovem trepetanju, v tekočini lahko držite le s pomočjo londonskih disperzijskih sil, ki so sorazmerne s površino njihovih kril in njeno molekulsko maso.
Lahko vam služi: karbonilna skupina: značilnosti, lastnosti, nomenklatura, reaktivnostLastnosti
Fizični videz
Brezbarven plin.
Molekularna masa
56,107 g/mol.
Vrelišče
12,6 ° C. Zato je v hladnih razmerah načeloma mogoče manipulirati kot katero koli tekočino; Z edino podrobnostjo, da bi bilo zelo nestanovitno, in njihovi hlapi bodo še vedno predstavljali tveganje za upoštevanje.
Tališče
-91 ° C.
točka vžiga
50 ° C zaprta skodelica.
Topnost
Netopna v vodi, kar ni presenečeno glede na svojo apolarno naravo; Toda v alkoholih, etru in acetonu je rahlo topno, ki so manj polarna topila. Pričakuje se, da bo v apolarnih topilih, kot so ogljikov tetraklorid, benzen, ksilen itd.
Gostota
0,7125 do 5 ° C (glede na 1 iz vode).
Gostota hlapov
1.93 (glede na 1 zraka). To pomeni, da je gosta od zraka, zato, če ne obstajajo tokovi, njegov trend ne bo naraščal.
Parni tlak
1.180 mmHg pri 25 ° C.
Lomni količnik
1.3625 do 290 ° C.
Entalpija zgorevanja
-655,9 kJ/mol.
Trdilna toplota
6,6 kcal/mol A 25 ° C.
Sinteza
Ciklobutan se sintetizira s hidrogenacijo ciklobutadiena, katerega struktura je skoraj enaka, z edino razliko, da ima dvojno vez; In zato je še bolj reaktiven. To je morda najpreprostejša sintetična pot, da jo pridobimo, ali vsaj samo njemu in ne za derivat.
V suromu naftu verjetno ne bo dosegel, saj bi na koncu reagiral tako, da je zlomil obroč in oblikovana linijska veriga, torej n-butan.
Druga metoda za pridobitev ciklobutana je vplivanje na ultravijolično sevanje na molekule etilena, CH2= Pogl2, ki se merijo. Ta reakcija je fotokemično favorizirana, vendar ne termodinamično:
Vam lahko služi: benchilo benzoate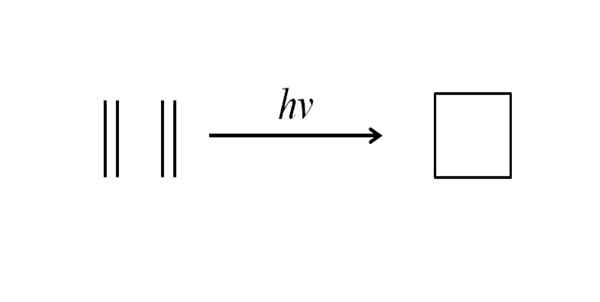 Sinteza ciklobutana z ultravijoličnim sevanjem. Vir: Gabriel Bolívar.
Sinteza ciklobutana z ultravijoličnim sevanjem. Vir: Gabriel Bolívar. Zgornja slika povzema tisto, kar je bilo rečeno v zgornjem odstavku. Če bi bili namesto etilena na primer, bi dobili kakršni koli dve alkeni, bi dobili nadomeščen ciklobutan; ali kaj je isto, ciklobutanski derivat. Pravzaprav je bilo s to metodo sintetiziranih veliko derivatov z zanimivimi strukturami.
Drugi derivati pa nakazujejo vrsto zapletenih sintetičnih korakov. Zato je ciklobuta (kot se imenujejo njihovi derivati) podvrženi študiju za organsko sintezo.
Prijave
Ciklobutana samo nima več koristi kot služiti kot vir toplote; Toda njegovi derivati vstopajo v zapletena zemljišča v organski sintezi, z uporabo v farmakologiji, biotehnologiji in medicini. Brez poglabljanja preveč zapletenih struktur sta penitrems in grandisol primeri ciklobutanov.
Ciklobutani imajo na splošno lastnosti, ki so koristne za presnove bakterij, rastlin, morskih nevretenčarjev in gliv. So biološko aktivni in zato so njihove uporabe zelo raznolike in težko določiti, saj vsak ima svoj poseben vpliv na določene organizme.
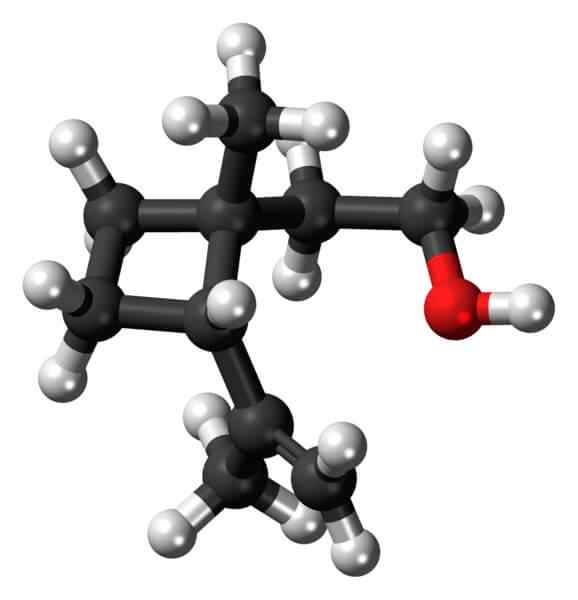 Grandisol: primer ciklobutanskega derivata. Vir: Jynto [CC0].
Grandisol: primer ciklobutanskega derivata. Vir: Jynto [CC0]. Grandisol, na primer, je Gorgjo feromon (vrsta hrošča). Zgoraj in končno je prikazana njegova struktura, ki velja za monoterpen s kvadratno podlago ciklobutana.
Reference
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons, t.W.; Craig b. Fryhle. (2011). Organska kemija. (enajstth izdaja). Wiley.
- Wikipedija. (2019). Ciklobutan. Pridobljeno iz: v.Wikipedija.org
- Pubchem. (2019). Ciklobutan. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Peiris Nicole. (29. november 2015). Fizikalne lastnosti cikloalkanov. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Wiberg b. Kenneth. (2005). Ciklobutansko-fizične lastnosti in teoretične študije. Oddelek za kemijo, univerza Yale.
- Klement foo. (s.F.). Ciklobutani v organski sintezi. Pridobljeno iz: scripps.Edu
- Myers. (s.F.). Sinteza ciklobutanov. Chem 115. Okreval od: hwpi.Harvard.Edu
- « Srebrna struktura Bromuro (AGBR), lastnosti in uporabe
- Značilnosti, vrste in učinki sintetičnih zdravil »

