Katalaze, struktura, funkcije, patologije
- 705
- 135
- Roman Schamberger
The Katalaza Gre za encim oksidoreduktaze (H2O2: H2O2 oksidoreduktaza), ki je široko porazdeljen v naravi. Katalize v različnih tkivih in vrstah celic "razgradnja" reakcije vodikovega peroksida pri molekularnem kisiku in vodi.
Prva opažanja te vrste encima segajo v zgodnje 1810 -ih, vendar je leta 1901, ko je Loew spoznal, da je katalaza praktično prisotna v vseh obstoječih živih organizmih in v več vrstah različnih celic.
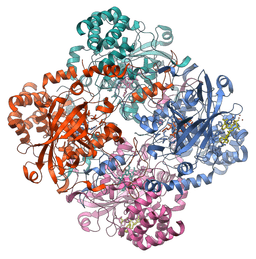
 Molekularna struktura katalaznega encima (vir: Vossman [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons)
Molekularna struktura katalaznega encima (vir: Vossman [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons) Ta encim, ki je ključnega.
Sesalci in drugi organizmi imajo encime katale, ki se lahko obnašajo tudi kot peroksidaze, katalizirajo oksidacijske reakcije različnih substratov z uporabo vodikovega peroksida.
V večini evkariotov so encimi Catalas prevladovano v podceličnih organelih, znanih kot "peroksisomi", pri ljudeh pa obstajajo številni patološki pogoji, povezani s pomanjkanjem tega encima.
[TOC]
Značilnosti
Aktivnost encimov, kot je katalaza, se lahko močno razlikuje glede na vrsto obravnavanega tkiva. Pri sesalcih je na primer aktivnost katalaze pomembna tako v ledvicah kot v jetrih in je v vezivnih tkivih veliko nižja.
Tako da je katalaza pri sesalcih povezana predvsem z vsemi tkivi, ki imajo pomembno aerobno metabolizem.
Sesalci imajo katale tako v mitohondrijih kot v peroksisomih, v obeh oddelkih pa so encimi, povezani z organskimi membranami. V eritrocitih je nasprotno, aktivnost katalaze je povezana s topnim encimom (ne pozabite, da imajo eritrociti malo notranjega organela).
Vam lahko služi: Half Stuart: fundacija, priprava in uporabaKatalaza je encim z velikim številom nadomestitve ali konstantne katalitike (je zelo hitra in učinkovita) in splošna reakcija, da katalizira:
2H2O2 → 2H2O + O2
V prisotnosti nizkih koncentracij vodikovega peroksida se na primer sesalska katalaza obnaša kot oksidaza z uporabo molekularnega kisika (O2), da oksidira molekule, kot sta indol in β-peniletilamin, predhodniki, ki.
Trenutno so znani nekateri konkurenčni inhibitorji dejavnosti katalaze in med njimi izstopajo natrij in 3-aminotriazol Azid. Azida je v svoji anionski obliki močan zaviralec drugih beljakovin s hemo skupinami in se uporablja za izločanje ali preprečevanje rasti mikroorganizma v različnih pogojih.
Struktura
Pri ljudeh katalazo kodira 34 kb gen, ki ima 12 intronov in 13 eksonov in kodira za 526 aminokislinskih beljakovin.
Večina proučenih katala je tetramerni encimi z molekulsko maso, ki je blizu 240 kDa (60 kDa za vsako podenoto) in vsak monomer je povezan s protetično skupino s heminom ali feroprotoporfirinom.
Njegova struktura je sestavljena iz štirih domen, sestavljenih iz sekundarnih struktur, ki jih tvorijo Alfa hellices in β-vodilni listi, in študije, opravljene v encimu jeter ljudi in goveda, so pokazale, da so ti proteini povezani s štiri.
Te molekule NADPH se ne zdijo bistvene za encimsko aktivnost katalaze (za proizvodnjo vode in kisika iz vodikovega peroksida), vendar se zdi, da se nanašajo na zmanjšanje občutljivosti tega encima v primerjavi z visokimi koncentracijami njegovega strupenega substrata.
Domene vsake podenote v katalazi ljudi so:
Vam lahko služi: karotenoidi-Razširjena neglobularna N-terminalna roka, ki deluje za stabilizacijo kvartarne strukture
-Β-barel osmih β-krat antiparalle, ki zagotavljajo nekatere ostanke stranskih stičišč v skupini Hemo
-Domena "zavijanja", ki obdaja zunanjo domeno, vključno s hemonsko skupino in končno
-Domena s strukturo alfa propelerja
Štiri podenote s temi štirimi domenami so odgovorne za nastanek dolgega kanala, katerega velikost je ključnega pomena za mehanizem prepoznavanja vodikovega peroksida z encimom (ki uporablja aminokisline, kot so histidin, asparagin, glutamin in asparaginska kislina ).
Funkcije
Po mnenju nekaterih avtorjev Katalaza izpolnjuje dve encimski funkciji:
-Razgradnja vodikovega peroksida v molekularni vodi in kisiku (kot specifična peroksidaza).
-Oksidacija darovalcev protonov, kot so metanol, etanol, številni formalni fenoli in kislina, z uporabo mola vodikovega peroksida (kot je nespecifična peroksidaza).
-V eritrocitih se zdi, da ima velika količina katalaze pomembno vlogo pri zaščiti hemoglobina pred oksidacijskimi sredstvi, kot so vodikova peroksid, askorbinska kislina, metilhidrazin in drugi.
Encim, prisoten v teh celicah, je odgovoren za obrambo drugih tkiv z malo aktivnosti katalaze v primerjavi z visokimi koncentracijami vodikovega peroksida.
-Nekatere žuželke, kot je bombni hrošč, uporabljajo katalazo kot obrambni mehanizem, saj vodikov peroksid razgradijo in uporabljajo plinasti kisik produkta omenjene reakcije, da poganjajo proizvodnjo vode in drugih kemičnih spojin v obliki oblike.
-V rastlinah je katalaza (prisotna tudi v peroksisomih) ena od komponent mehanizma fotorerspiracije, med katerimi se za proizvodnjo 3-fosfoglicera uporablja fosfoglikat, ki ga proizvaja encim Rubisco.
Vam lahko služi: loos cikelPovezane patologije pri ljudeh
Glavni viri proizvodnje substrata katalaze vodikovega peroksida so reakcije, ki jih katalizirajo encimi oksidaze, reaktivni kisik in nekatere tumorske celice.
Ta spojina je vključena v vnetne procese, pri izražanju lepilnih molekul, pri apoptozi, pri regulaciji agregacije trombocitov in pri nadzoru celične proliferacije.
Ko obstajajo pomanjkljivosti tega encim.
Med boleznimi, povezanimi z mutacijami v kodirnem genu za katalazo ljudi, je mogoče omeniti:
-Diabetes mellitus
-Arterijska hipertenzija
-Alzheimerjeva
-Vitiligo in drugi
Reference
- Agar, n., Sadrzadeh, s., Findo, str., & Eaton, J. (1986). Eritrocitna katalaza. Somatska oksidacijska obramba? J. Klinika. Investirati., 77, 319-321.
- Góth, l., Rass, str., & Plačaj. (2004). Mutacije encimov katalaze in njihova povezanost z dizajni. Molekularna diagnoza, 8(3), 141-149.
- Kirkman, h., & Gaetanit, g. F. (1984). Katalaza: Tetramerni encim s štirimi tesno vezanimi molekulami NADPH. Proc. Natl. Acade. Sci. Uporaba, 81, 4343-4347.
- Kirkman, h. N., & Gaetani, g. F. (2006). Katalaza sesalcev: častitljivi encim z novimi skrivnostmi. Trendi v biokemijskih znanostih, 32(1), 44-50.
- Rawn, j. D. (1998). Biokemija. Burlington, Massachusetts: Založniki Neil Patterson.
- Salomon, e., Berg, l., & Martin, D. (1999). Biologija (5. izd.). Philadelphia, Pennsylvania: Saunders College Publishing.
- VINSHTEIN, b., Melin-Adamyan, w., Barynin, v., Vagin, a., & Grebenko, a. (1981). Tridimenzionalna struktura encimske katalaze. Narava, 293(1), 411–412.
- « Značilnosti, struktura, funkcije lacasas
- Enakomerno pospešene lastnosti pravokotnega gibanja, formule »

