Struktura cinkovega karbonata (ZNCO3), lastnosti, uporablja

- 3057
- 53
- Raymond Moen
On cink karbonat To je anorganska spojina, ki jo tvorijo elementi cinka (Zn), ogljika (C) in kisika (O) (O). Njegova kemična formula je Znco3. Cink ima stanje oksidacije +2, ogljika +4 in kisika -2.
To je brezbarvna ali bela trdna snov, ki jo najdemo v naravi, ki tvori mineral Smithsonite, v katerem je lahko sam ali z drugimi elementi, kot sta kobalt ali baker, ki ji daje vijolično ali zeleno obarvanost.
 Smithsonita, mineral Znco3. Rob Lavinsky, Irocks.com-cc-by-sa-3.0/cc BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Smithsonita, mineral Znco3. Rob Lavinsky, Irocks.com-cc-by-sa-3.0/cc BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. Znco3 V vodi je skoraj netopna, vendar se zlahka raztopi v razredčenih kislinah, saj karbonatni ion v kisli karbonični obliki (H2Co3), ki nato postane plinski plin2 in voda.
Uporablja se kot antiseptik pri živalskih ranah in se včasih dobavlja v prehrani, da se izognemo boleznim, ki jih povzroča pomanjkanje cinka.
Služi za odlašanje zgorelih, da nekatera vlakna, plastika in dlesni, ko pridejo v stik z ognjem. Omogoča varno ločevanje strupenih arzenih mineralov iz drugih kamnin.
Uporablja se v zobnih pastah za obnovitev dentina v zobeh pod beljenjem.
[TOC]
Struktura
Znco3 Tvori ga zn kation2+ in anion co32-. Ogljik v karbonatnem ionu ima stanje oksidacije +4. Ta ion ima ravno strukturo s tremi atomi kisika, ki obdajajo ogljikov atom.
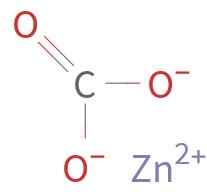 Kemična struktura cinkovega karbonata. Neznani avtor / javna domena. Vir: Wikimedia Commons.
Kemična struktura cinkovega karbonata. Neznani avtor / javna domena. Vir: Wikimedia Commons. Nomenklatura
- Cink karbonat
- Cinkov monokarbonat
- Cinkova sol karbonske kisline
- Smithsonita
- Pojavljanje cinka
Lastnosti
Fizično stanje
Brezbarvna trdna ali kristalno bela. Rombični kristali.
 Cink karbonat. Ondřej mangl / pub domena. Vir: Wikimedia Commons.
Cink karbonat. Ondřej mangl / pub domena. Vir: Wikimedia Commons. Molekularna teža
125,4 g/mol
Tališče
Pri 140 ° C se pokvari, ne da bi se talil.
Gostota
4.398 g/cm3 pri 20 ° C.
Topnost
Praktično netopna v vodi: 0,000091 g/100 g H2Ali pri 20 ° C. Topno v razredčenih kislinah, alkaliji in amonijevi soli. Netopna v amoniaku, alkoholu in acetonu.
Kemične lastnosti
Reagira s kislinami, ki tvorijo ogljikov dioksid:
Znco3 + 2 h+ → Zn2+ + H2Ali + co2↑
Raztopi se v bazah, ki tvorijo hidroksid, ki se delno raztopi, ki tvori ion cinkato:
Vam lahko služi: bromova: zgodovina, struktura, elektronska konfiguracija, lastnosti, uporabeZnco3 + 2 Oh- → Zn (OH)2 + Co32-
Zn (OH)2 + H2Ali + oh- → [Zn (OH)3(H2Bodisi)]-
Ni vnetljivo. Ko se segreje na njegovo razgradnjo, povzroči cinkov oksid in ogljikov dioksid, lahko pa oddaja ogljikov monoksid (CO).
Znco3 + toplota → ZnO + Co2↑
Pridobivanje
Pridobljen je mineral Smithsonite, prej se imenuje Kinkovo spat.
Pripravimo ga lahko tudi z mešanjem natrijeve karbonatne raztopine s cinkovo soljo, kot je cinkov sulfat. Natrijev sulfat ostane raztopljen in cinkov karbonat obori:
Znso4 + Na2Co3 → Znco3↓ + NA2SW4
Prijave
Pri medicinskih tretmajih
Ta spojina vam omogoča, da pridobite nekaj farmacevtskih izdelkov. Nanese se na vneto kožo v obliki prahu ali losjona.
V veterinarskih aplikacijah
Znco3 Služi kot adstrigentni, antiseptični in lokalni zaščitnik živali pri živalih.
Omogoča tudi preprečevanje bolezni, ki jih povzroča pomanjkanje cinka, zato se uporablja kot dodatek pri prehrani nekaterih živali, pod pogojem.
 Cinkov karbonat se včasih daje kot mikrohranil, da se izognemo boleznim pri prašičih. Neznani avtor / CC0. Vir: Wikimedia Commons.
Cinkov karbonat se včasih daje kot mikrohranil, da se izognemo boleznim pri prašičih. Neznani avtor / CC0. Vir: Wikimedia Commons. Pri izbruhih porheratoze pri prašičih ga dodamo prehrani teh. Ta bolezen je sprememba kože, v kateri ni pravilno oblikovana plast roženice.
Kot retard plamena
Uporablja se kot ognjevalno nadev za gumo in plastiko, ki je izpostavljena visokim temperaturam. Omogoča zaščiti tekstilnih vlaken pred ognjem.
V primeru bombažnega tekstila se nanaša na tkanino skupaj z nekaj alkalij. To neposredno napada primarne hidroksilne skupine (-CH2Oh) celuloze in jih naredi sodioceluloze (-CH2Ona).
Razpad celuloze z alkalijem daje prednost večji prodornosti verig kompaktne celulozne strukture, tako da več količine Znco3 uspe vstopiti v amorfno območje tega in njegova disperzija je olajšana.
Vam lahko služi: vanadij: zgodovina, lastnosti, struktura, uporabe Nekatere bombažne tkanine lahko vsebujejo Znco3 v svojih vlaknih, da bi bili odporni na ogenj. Socken_farbig.JPEG: Scott Bauererivative delo: nogavica / javna domena. Vir: Wikimedia Commons.
Nekatere bombažne tkanine lahko vsebujejo Znco3 v svojih vlaknih, da bi bili odporni na ogenj. Socken_farbig.JPEG: Scott Bauererivative delo: nogavica / javna domena. Vir: Wikimedia Commons. Zaradi tega se zmanjša količina vnetljivega plina, ki se lahko pojavi z ognjem.
Pri zobnih tretmajih
Nekatere dentifrične kreme, ki temeljijo na cinkovih karbonatnih nanokristalih in hidroksiapatitu, ki se redno uporabljajo za protezo, učinkoviteje zmanjšujejo preobčutljivost kot tiste, ki temeljijo na fluoridu.
Nanokristali Znco3 in hidroksiapatit ima velikost, obliko, kemično sestavo in kristalnost, podobno kot pri dentinu.
 Nanodelci Znco3-HydroxiaPatit je bil uspešno testiran za zmanjšanje občutljivosti v beljenih zobeh. Avtor: Fotografska mešanica. Vir: Pixabay.
Nanodelci Znco3-HydroxiaPatit je bil uspešno testiran za zmanjšanje občutljivosti v beljenih zobeh. Avtor: Fotografska mešanica. Vir: Pixabay. Ta vrsta zobnih past je bila uporabna po postopkih belitve zob.
Ločiti nevarne minerale arzena
Arzenske mineralne metode žveplovih kamnin (kot so Galena, halkopirit in pirit) so bile testirane z uporabo ZnCO)3. Ruda v arzenu mora biti ločena od drugih, ker je ta element zelo strupeno in strupeno onesnaževalo za živa bitja.
Da bi to dosegli, mešanico zemeljskih kamnin obdelamo z raztopino cinkovega sulfata in natrijevim karbonatom na pH 7,5-9,0 in ksantatsko spojino.
 Arsenopirita. Ta mineral je treba ločiti od drugih, ker vsebuje strupeno arzen. Ločitev je mogoče doseči s cinkovim karbonatom. James St. John/cc by (https: // creativeCommons.Org/licence/by/2.0. Vir: Wikimedia Commons.
Arsenopirita. Ta mineral je treba ločiti od drugih, ker vsebuje strupeno arzen. Ločitev je mogoče doseči s cinkovim karbonatom. James St. John/cc by (https: // creativeCommons.Org/licence/by/2.0. Vir: Wikimedia Commons. Učinkovitost formule je pripisana tvorbi majhnih delcev ZnCO3 Na površini arsenopirita, zaradi česar je hidrofilni (povezan z vodo), zato se ne morete držati zračnih mehurčkov in ne morete plavati, oboriti in ločevati od drugih mineralov.
Pri pridobivanju drugih cinkovih spojin
Cinkov karbonat je bil uporabljen za pridobivanje hidrofobnih nanostruktur borata formule 3ZNO • 3b2Tudi3• 3.5H2Tudi. Ta material lahko uporabite kot aditiv za zaviralce v plamenu v polimerih, lesu in tekstilu.
Pri obnovi cinka preostalih odtokov
Bogate sintetične vode na cinkovih ionih, zavrženih s postopki elektrodezicije, lahko zdravimo s fluidizirano tehnologijo s pomočjo natrijevega karbonata za oborino Znco3.
Vam lahko služi: sekundarni alkohol: kaj je, struktura, lastnosti, uporabeKo Zn obori2+ V obliki karbonata zmanjša koncentracijo, dobljena trdna snov se filtrira in vode lahko varno zavržemo. Znco3 oborina je velika čistost.
Druge aplikacije
Omogoča pripravo drugih cinkovih spojin. Uporablja se v kozmetiki. Služi kot pigment in se uporablja pri proizvodnji porcelana, keramike in lončarstva.
Tveganja
Vdih za prah Znco3 Lahko povzroči vladajo, kašelj, prsni koš, vročino in nelagodje z znojenjem. Njegovo zaužitje povzroča slabost in bruhanje.
Učinki na okolje
Glavno tveganje je njegov vpliv na okolje, zato se mu je treba izogibati raztresenosti. Za vodno življenje je zelo strupeno s posledicami, ki trajajo v živih organizmih.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Cink karbonat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Sharma, v. et al. (2018). Sinteza cinkovih karbonatnih nanoneed, do potencialnega retardarja za plamen za bombažni tekstil. Celuloza 25, 6191-6205 (2018). Povezava je bila obnovljena.Springer.com.
- Guan in. et al. (2020). Koloidni Znco3 kot močan depresiv arsenopirita v šibko alkalni celulobi in mehanizmu interakcije. Minerali 2020, 10, 315. MDPI se je okreval.com.
- Bolezni kože, oči, konjunktive in zunanjega ušesa. (2017). V veterinarski medicini (enajsta izdaja). Okrevano od Scientirect.com.
- Hannig, m. in Hannig, c. (2013). Nanobiomateriali v preventivni zobozdravstvu. V nanobiomaterialih v klinični zobozdravstvu. Poglavje 8. Okrevano od Scientirect.com.
- Tugrul, n. et al. (2015). Sinteza hidrofobnih nanostruktur cinkov Borrat iz cinkovega karbonata in karakterizacija izdelka. Res Chem Intermediate (2015) 41: 4395-4403. Povezava je bila obnovljena.Springer.com.
- Luna, m.D.G., et al. (2020). Obnovitev cinkovih zrnc iz sintetične galvalne odpadne vode s pomočjo homogenega procesa kristalizacije s fluidizirano K-K-K-K-K-K-KK. Int. J. Okolje. Sci. Technol. 17, 129-142 (2020). Povezava je bila obnovljena.Springer.com.

