Struktura litijevega karbonata (li2CO3), lastnosti, uporabe

- 2397
- 747
- Miguel Gutmann DVM
On litijev karbonat Gre za anorgansko trdno snov, ki jo tvorita dva litij li+ in karbonat anion co32-. Njegova kemična formula je li2Co3. Li2Co3 Gre za belo kristalno trdno snov, ki jo lahko dobimo z reakcijo med litijevim hidroksidom in ogljikovim dioksidom.
Litijev karbonat ima zelo visoko fuzijsko točko, zato se uporablja pri pripravi stekla, keramike in porcelana. Ima zelo raznolike uporabe, na primer polnilne litijeve baterije, pri pripravi drugih litijevih spojin, varilnih elektrod ter v slikah in lakih.
 Litijev karbonat li2Co3 trden. Slika, ki jo je posnel W: Uporabnik: Walkerma junija 2005. Vir: Wikimedia Commons.
Litijev karbonat li2Co3 trden. Slika, ki jo je posnel W: Uporabnik: Walkerma junija 2005. Vir: Wikimedia Commons. Uporablja se tudi Li2Co3 V cementnih mešanicah za doseganje hitrega nastavitve in proizvodnje aluminija.
Ena najpomembnejših načinov je pri zdravljenju nekaterih duševnih bolezni, kot so depresija in pretirano agresivno vedenje, med drugim.
Vendar morajo njeno uporabo kot zdravilo ustrezno nadzorovati medicinski strokovnjaki, ker se ljudje zdravijo z Li2Co3 Lahko trpijo škodljive učinke za zdravje, kot je hipotiroidizem (zmanjšana funkcija ščitnice).
[TOC]
Struktura
Litijev karbonat sestavljata dva litij li+ in karbonat anion co32-.
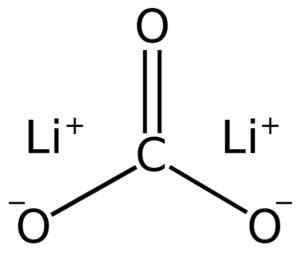 Lii litij karbonatna struktura2Co3. Adrian Hands [javna domena]. Vir: Wikimedia Commons.
Lii litij karbonatna struktura2Co3. Adrian Hands [javna domena]. Vir: Wikimedia Commons. Elektronska konfiguracija litija v stanju oksidacije +1 je 1S2 2s0, No, izgubil je elektron zadnje plasti, s čimer je bil bolj stabilen. Karbonatni ion co32- Ima ravno strukturo.
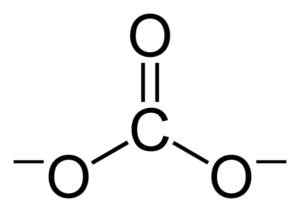 Ravna struktura premoga iona co32-. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Ravna struktura premoga iona co32-. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Negativne obremenitve so enakomerno razporejene med tremi kisikovnimi atomi premoga iona CO32-.
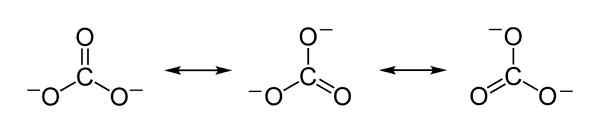 Teoretične resonančne strukture karbonatnega iona co32- ki služijo za razlago pravične porazdelitve negativnih obremenitev med 3 atomi kisika. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Teoretične resonančne strukture karbonatnega iona co32- ki služijo za razlago pravične porazdelitve negativnih obremenitev med 3 atomi kisika. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Nomenklatura
-Litijev karbonat
-RAZLIČA KARBONAT
Fizične lastnosti
Fizično stanje
Kristalno bela trdna snov monoklinične strukture
Molekularna teža
73,9 g/mol
Tališče
723 ° C
Razgradnja
Razpade pri 1300 ° C.
Gostota
2.11 g/cm3
Topnost
Malo topno v vodi: 1,31 % po teži pri 20 ° C. Njegova topnost vode se znižuje, ko se temperatura povečuje. Je topna v razredčenih kislinah. Je netopna v alkoholu in acetonu.
Vam lahko služi: barijev oksid (BAO): struktura, lastnosti, uporabe, tveganjaph
Vodne raztopine so alkalne, imajo pH večji od 7.
Kemične lastnosti
Li2Co3 Hidrolizira je v vodni raztopini, ki ustvarja osnovno raztopino. Majhen delež spojine, ki je solubilizirana v vodi32-.
Karbonat anion co32- Prosto v vodni raztopini potrebuje proton, da tvori HCO bikarbonatni anion3-, Kot je razvidno iz naslednje reakcije:
Co32- + H2O → HCO3- + Oh-
Prisotnost OH ionov- Je tisto, zaradi česar je rešitev osnovna.
Biološke lastnosti
V živalskih in človeških tkivih so običajno sledi litij -ionov, toda do trenutka, ko ni znana naravna fiziološka vloga tega iona.
V človeškem organizmu lije2Co3 zaužijemo kot zdravila, deluje na različne signalne mehanizme v nevronih in drugih celicah. To je posledica zamenjave kationov, kot sta natrij in kalij.
Vključitev litijevega iona v strukturo celične membrane lahko spremeni odziv na hormone in celično spajanje z energijskimi procesi.
Na ta način litij spreminja več celičnih procesov, vključno z metabolizmom.
S spreminjanjem načina delovanja celic2Co3 Lahko delujete na komunikacijske mehanizme nevronov v možganih.
Pridobivanje
Li2Co3 Dobimo ga lahko z litijevim hidroksidnim reakcijo z ogljikovim dioksidom Co2, Kot je prikazano spodaj:
2 lioh + co2 → li2Co3 + H2Tudi
Komercialno se pojavlja iz mineralov, ki vsebujejo litij, kot sta Spodumen in Lepidolit. Ti minerali se zdravijo pri visokih temperaturah z določenimi sulfatnimi soli ali z alkalnimi spojinami, da dobimo litijeve soli.
Pridobljene litijeve soli se očistijo z vodnimi ali kislinskimi raztopinami, nato pa jih zdravimo z karbonatom, da tvorijo li2Co3.
Vendar pa Li2Co3 Na ta način je kontaminiran s sulfati ali kalcijevimi kloridi, magnezijem, železom, natrijem, kalijem itd. Zato zahtevajte poznejše čiščenje.
Prijave
Pri zdravljenju duševnih bolezni
Uporablja se kot antidepresiv, antimaniakni agent, pri zdravljenju agresivno-impulzivnega vedenja in bipolarnih motenj (ljudje, ki nenadoma spremenijo svoj humor, brez kakršnega koli razloga, postanejo nasilni).
Vam lahko služi: 20 primerov kemične sublimacije in značilnosti Nekatere agresivno-impulzivne motnje lahko zdravite z Li2Co3. Avtor: Prawny. Vir: Pixabay.
Nekatere agresivno-impulzivne motnje lahko zdravite z Li2Co3. Avtor: Prawny. Vir: Pixabay. Zdravniki so opazili, da njihova uprava vodi k zmanjšanju intenzivnosti in pogostosti hudih obdobij depresije in maničnih epizod.
Uporablja se sam, to je brez dodane spojine pri vzdrževalni terapiji unipolarne depresije in pri shizoecifični motnji. Služi tudi za povečanje antidepresiva drugih zdravil.
Čeprav se uporablja za zdravljenje otrok z očitnimi simptomi bipolarne motnje in hiperaktivnost z nevrotičnimi ali agresivnimi sestavinami, v vseh primerih ni bil učinkovit.
Pri zdravljenju simptomov drugih bolezni
Uporablja se za zmanjšanje pogostosti močnih glavobolov, ponavljajočih se in kroničnih.
Uporablja se za zmanjšanje pojavnosti okužbe pri bolnikih z nevtropenijo, ki jo povzroča kemoterapija. Nevtropenija je zmanjšanje nevtrofilcev, vrste belih krvnih celic, ki pomagajo v boju proti okužbam v telesu.
Za zdravljenje hipertiroidizma se uporablja kot zaviralec ščitničnih encimov, vendar zaradi svojih škodljivih učinkov ni prednostno zdravljenje.
Oblika administracije
Uporablja se v obliki li tablet ali kapsul2Co3. Tudi v počasnih tabletah z litijevim citratom. LI je prednostna2Co3 Ker ne draži grla, ko ga požirate, kot se zgodi z drugimi litijevimi soli.
 Avtor: Pete Lyforth. Vir: Pixabay.
Avtor: Pete Lyforth. Vir: Pixabay. Neželeni učinki
Li2Co3 Lahko škoduje vpliva na ščitnico in ledvice, zato je treba funkcijo teh organov spremljati pred in med zdravljenjem s to spojino.
Li2Co3 V koncentracijah je lahko strupena zelo blizu tistih, ki se uporabljajo v medicinskih tretmajih, zato je potreben neprekinjen pregled njihovih vrednosti krvnega seruma.
Li Simptomi zastrupitve2Co3 So med drugim tresenje, mišični krči, mišična šibkost, driska, bruhanje, zaspanost ali ataksija (poslabšanje pri koordinaciji mišic).
Na začetku lirapije2Co3 Lahko pride do simptomov, kot so tresenje, glavoboli in slabost. Toda ti ponavadi izginejo z nadaljevanjem zdravil.
Vam lahko služi: HolmioVečina zdravljenih ljudi lahko razvije tudi levkocitozo (povečanje števila belih krvnih celic), vendar je to reverzibilno.
Ljudje, ki zdravijo z Li2Co3 Ne smejo ravnati z vozili ali upravljati strojev, ker zmanjšuje fizično koordinacijo in sposobnost izvajanja dejavnosti, ki jih je treba pozorni.
Primeri, v katerih ga ne smemo dajati
Ne smete se uporabljati pri otrocih, mlajših od 12 let, saj lahko ovira nastanek kosti in njihovo gostoto, saj spreminja koncentracije ščitničnega hormona. Prav tako se ponavadi zavzema za kraj kalcija v kosteh.
Ne smejo se zdraviti z Li2Co3 Ljudje s srčno -žilnimi boleznimi, ledvicami ali ščitnico. Niti pri hudo dehidriranih bolnikih.
Nosečnice ne smejo dajati zlasti v prvem trimesečju nosečnosti. Litij prečka posteljico in zlahka doseže plod z morebitnimi teratogenimi učinki, to je, da lahko pri dojenčku ustvari nepravilnosti ali nepravilnosti.
Starejši ljudje, ki potrebujejo zdravljenje z Li2Co3 Z njimi je treba ravnati z veliko previdnostjo in z odmerki nižji od mladih odraslih, saj lahko razvijejo hipotiroidizma.
Druge uporabe
Li2Co3 Visoka čistost se pogosto uporablja pri proizvodnji baterij za ponovno polnjenje litijev.
Uporablja se v gorivnih celicah staljenega karbonata.
Uporablja se pri proizvodnji električnega porcelana, ki je vrsta električne energije, ki izolira porcelan. Uporablja se tudi pri proizvodnji zasteklitve na keramiki.
 Li2Co3 Uporablja se za izdelavo električnega porcelana, ki se uporablja kot električni izolator, na primer v električnih napajalnih stebrih. Fir0002 flagstoffotos [at] gmail.com Canon 20D + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.GNU.Org/licence/stare licence/fdl-1.2.html)]. Vir: Wikimedia Commons.
Li2Co3 Uporablja se za izdelavo električnega porcelana, ki se uporablja kot električni izolator, na primer v električnih napajalnih stebrih. Fir0002 flagstoffotos [at] gmail.com Canon 20D + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.GNU.Org/licence/stare licence/fdl-1.2.html)]. Vir: Wikimedia Commons. Omogoča pripravo keramike z nizkim koeficientom razširitve, to je, da se pri povečanju temperature zelo malo razširi, tako da se keramika lahko uporabi v intervalu z višjim temperaturo.
Druge njegove uporabe so kot katalizator v proizvodnji drugih litijevih spojin, kot so varilne elektrode, v luminescentnih barvah barve, lakov in barvil, pa tudi v aluminijasti elektrolitni proizvodnji.
Uporabno je za ustvarjanje hitrejšega nastavitve cementa in dodaja lepilo za ploščice, tako da jih je mogoče popraviti v kratkem času.
 Avtor: capri23auto. Vir: Pixabay.
Avtor: capri23auto. Vir: Pixabay. Reference
- Cai, w. et al. (2018). Odstranitev SO42- od Li2Co3 s prekristalizacijo v Na2Co3. Kristali 2018, 8, 19. MDPI se je okreval.com.
- Gadikota, g. (2017). Povezovanje morfoloških in kristalnih strukturnih sprememb med pretvorbo litijevega hidroksidnega monohidrata v litijev karbonat z uporabo meritev več-lestvic. Minerali 2017, 7, 169. MDPI se je okreval.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Litijev karbonat. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Četrta izdaja. John Wiley & Sons.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. VCH Verlagsgellschaft MBH.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- « Primeri notranje in zunanje konjugirane kote, vaje
- .Struktura stearinske kisline (CH3 (CH2) 16COOH), lastnosti, uporabe »

