Barijev karbonat (BACO3)
- 1963
- 414
- Dexter Koch
Kaj je barijev karbonat?
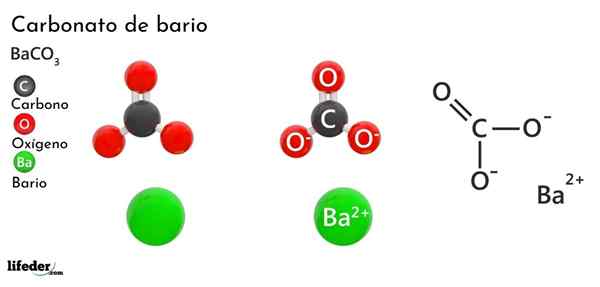
On Barijev karbonat To je anorganska sol kovinskega bario, predzadnji element skupine 2 periodične tabele in ki spada v alkalinoterne kovine. Njegova kemična formula je Bacchus3 In je na voljo na trgu v obliki belega kristalnega prahu.
Kako je pridobljeno? Kovinski barij najdemo v mineralih, kot je barit (baso4) in belita (Bacchus3). Whiterita je povezana z drugimi minerali, ki v zameno za obarvane ostanejo ravni čistosti do njenih belih kristalov.
Za ustvarjanje Bacchusa3 sintetične uporabe je potrebno za odpravo nečistoč belita, kot kažejo naslednje reakcije:
Bacchus3(s, nečisto) + 2nh4Cl (s) + q (toplota) => bacl2(aq) + 2nh3(g) + h2Ali (l) + co2(g)
Bacl2(aq) + (nh4)2Co3(s) => bacchus3(s) + 2nh4CL (aq)
Barita pa je glavni vir barija, zato se iz tega začnejo industrijske produkcije barijevih spojin. Ta mineral sintetizira barijev sulfid (BAS), izdelek, iz katerega teče sinteza drugih spojin in Bacchus3:
Bas (s) + na2Co3(s) => bacchus3(s) + na2H.H)
Bas (s) + co2(g) + h2Ali (l) => bacchus3(s) + (nh4)2S (aq)
Bario karbonatne lastnosti
 Barijev karbonatni prah
Barijev karbonatni prah Je prašna, bela in kristalna. To je stranišče, razplet in njegova molekulska teža je 197,89 g/mol. Ima gostoto 4,43 g/ml in neenakomerni tlak s paro.
Ima stopnjo loma 1.529, 1.676 in 1.677. Witerita oddaja svetlobo, ko absorbira ultravijolično sevanje: od svetle bele svetlobe z modrikastimi toni, do rumene luči.
Je zelo netopna v vodi (0,02 g/L) in v etanolu. V raztopinah HCl kisline tvori topno bario kloridno sol (bacl2), ki pojasnjuje svojo topnost v teh kislih medijih. V primeru žveplove kisline obori, kako netopna baza soli4.
Vam lahko služi: beril oksid (čebela)Bacchus3(s) + 2HCl (aq) => bacl2(aq) + co2(g) + h2Ali (l)
Bacchus3(s) + h2SW4(aq) => baso4(s) + co2(g) + h2Ali (l)
Ker je ionska trdna. Barijev karbonat se topi pri 811 ° C; Če se temperatura zviša okoli 1380-1400 ° C, slana tekočina namesto vrelice trpi kemično razgradnjo. Ta postopek se zgodi za vse kovinske karbonate: MCO3(s) => mo (s) + co2(g).
Toplotna razgradnja
Bacchus3(s) => bao (s) + co2(g)
Če je za ionske trdne snovi značilno, da so zelo stabilne, zakaj se karbonati pokvarijo? Ali kovina spremeni temperaturo, pri kateri se trdna snov pokvari? Ioni, ki sestavljajo barijev karbonat, so BA2+ in co32-, Oba zajetna (torej z velikimi ionskimi radijskimi sprejemniki). Co32- Odgovoren je za razgradnjo:
Co32-(s) => o2-(g) + co2(g)
Oksidni ion (ali2-) Kovina je povezana s kovinskim, kovinskim oksidom. Mo ustvari novo ionsko strukturo, v kateri je praviloma bolj podobna velikost njegovih ionov, bolj stabilna struktura (omrežna entalpija). Zgodi se nasprotno, če ioni m+ jaz2- Imajo zelo neenake ionske radijske sprejemnike.
Če je omrežna entalpija velika, je reakcija razgradnje energijsko naklonjena, kar zahteva manjše temperature ogrevanja (nižje vrelišča)).
Po drugi strani pa, če ima MO majhno omrežno entalpijo (kot v primeru BAO, kjer BA2+ Ima večji ionski radio kot oz2-) Razgradnja je manj naklonjena in zahteva višje temperature (1380-1400 ° C). V primerih MGCO3, Tat3 in srco3, Se razgradijo pri nižjih temperaturah.
Vam lahko služi: magnezij: zgodovina, struktura, lastnosti, reakcije, uporabeKemična struktura
Anion co32- Ima dvojno vez, ki odmeva med tremi atomi kisika, dva od teh negativno nabita, da bi pritegnila kation BA2+.
Medtem ko se obe ioni lahko štejeta za naložene krogle, je co32- Ima ravno trigonalno geometrijo (ploščati trikotnik, ki so ga narisali trije kisikovi atomi), morda je negativna "blazinica" za BA2+.
Ti ioni elektrostatično medsebojno delujejo tako.
V tem primeru, zakaj Bacchus ni topna3 V vodi? Pojasnilo preprosto temelji na dejstvu, da so ioni bolje stabilizirani v kristalni mreži, kot pa hidrirani s sferičnimi molekularnimi plastmi vode.
Iz drugega zornega kota molekule vode težko premagajo močne elektrostatične znamenitosti med obema ionima. Znotraj teh kristalnih omrežij lahko nastanejo nečistoče, ki dajejo barvo svojim belim kristalom.
Prijave
Na prvi pogled je bacchus del3 Morda ne bo obljubljal nobene praktične uporabe v vsakdanjem življenju, če pa obstaja kristal belega minerala, belega kot mleko, začne smiselno, zakaj je njegovo gospodarsko povpraševanje.
Se uporablja za izdelavo barijevega stekla ali kot dodatek za njihovo okrepitev. Uporablja se tudi pri izdelavi optičnega stekla.
Zaradi odlične entalpije omrežja in netopnosti se uporablja pri izdelavi različnih vrst zlitin, gume, ventilov, tal, slik, keramike, maziva, plastike, maščob in cementov.
Uporablja se tudi kot strup za miši. Če povzamemo, se ta sol uporablja za proizvodnjo drugih barijev spojin in tako služi kot materiali elektronskih naprav.
Vam lahko služi: sulfanilna kislina: struktura, lastnosti, sinteza, uporabaBacchus3 Lahko sintetiziramo kot nanodelce, kar izraža zelo majhne lestvice nove zanimive lastnosti belita. Ti nanodelci se uporabljajo za prežemanje kovinskih površin, zlasti kemičnih katalizatorjev.
Ugotovljeno je bilo, da izboljšuje oksidacijske katalizatorje in da nekako daje prednost migraciji molekul kisika po njegovi površini.
Šteje se za pripomočke za pospešitev procesov, v katerih je kisik vključen. In končno se uporabljajo za sintezo supramolekularnih materialov.
Tveganja
Bacchus3 Je strupena zaradi zaužitja, kar povzroča neskončnost neprijetnih simptomov, ki vodijo v smrt zaradi odpovedi dihanja ali srčnega zastoja; Zaradi tega ni priporočljivo prevoz poleg užitnega blaga.
Poleg kašlja in bolečine v grlu proizvaja rdečico oči in kože. To je strupena spojina, čeprav zlahka manipulira z golimi rokami.
Ni vnetljivo, toda pri visokih temperaturah se pokvari, ki tvorijo bao in co2, Strupeni in oksidacijski izdelki, zaradi katerih lahko drugi materiali gori.
V organizmu se barij odlaga v kosti in drugih tkiv, ki nadomešča kalcij v mnogih fizioloških procesih. Prav tako blokira kanale, kamor potujejo k ioni+, preprečevanje njene difuzije skozi celične membrane.
Reference
- Pubchem. (2018). Barijev karbonat. Pridobljeno 24. marca 2018 iz Pubchem: Pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2017). Barijev karbonat. Pridobljeno 24. marca 2018 iz Wikipedije: IN.Wikipedija.org
- Kemijna knjiga. (2017). Barijev karbonat. Pridobljeno 24. marca 2018 iz kemijske knjige: Kemični knjigo.com
- Robbins Manuel a. (1983).Robbins zbirateljska knjiga fluorescentnih mineralov. Opis fluorescentnih mineralov, P-117.
- Shiver & Atkins. (2008). Anorganska kemija. V Struktura preprostih trdnih snovi (Četrta izdaja., str. 99-102). MC Graw Hill.