Amonijev karbonat ((NH4) 2CO3)
- 4894
- 1297
- Adrian Legros
Kaj je amonijev karbonat?
On Amonijev karbonat Gre za anorgansko dušikovo sol, zlasti amonialno, katere kemična formula je (NH4)2Co3. Izdelana je z metodami sinteze, med katerimi je vredno uporabiti sublimacijo mešanice amonijevega sulfata in kalcijevega karbonata: (NH4)2SW4(s)+ caco3(s) => (nh4)2Co3(s)+ primer4(S).
Na splošno se amonijeve soli in kalcijev karbonat segrejeta v posodi, da povzročijo amonijev karbonat. Industrijska metoda, ki proizvaja tone te soli.
Hlapi, ki vsebujejo amonij, ogljikov dioksid in vodo3(g)+ h2Ali (l) + co2(g) → (NH4)2Co3(S). V reakciji pride do ogljikove kisline, h2Co3, Po raztapljanju ogljikovega dioksida v vodi in prav ta kislina daje dva protona, h+, do dveh molekul amoniaka.
Lastnosti amonijevega karbonata
 Videz amonijevega karbonata
Videz amonijevega karbonata Je bela, kristalna in brezbarvna trdna snov, z močnimi vonji in amonijanskimi okusi. Topi na 58 °.
Vendar se ta razgradnja pojavi v dveh korakih: najprej se sprosti molekula NH3, Proizvajanje amonijevega bikarbonata (NH4HCO3); In drugič, če se ogrevanje nadaljuje, je karbonat nesorazmerno.
Je trdna topna v vodi in manj topna v alkoholih. Tvorijo vodikove mostove z vodo in ko se 5 gramov raztopi v 100 gramih vode, ustvari osnovno raztopino s pH okoli 8,6.
Vam lahko služi: emulzifikator: postopek emulzije, molekularni vidiki, aplikacijeNjegova visoka afiniteta do vode izdeluje higroskopska trdna snov (absorbira vlago), zato jo je težko najti v svoji anhidridni obliki. Pravzaprav je njegova monohidratna oblika (NH4)2Co3· H2O), je najpogostejša od vseh in pojasnjuje, kako je sol nosilec amoniaka, ki povzroča vonj.
V zraku se razgradi, da ustvari amonijev bikarbonat in amonijev karbonat (NH4Nh2Co2).
Kemična struktura
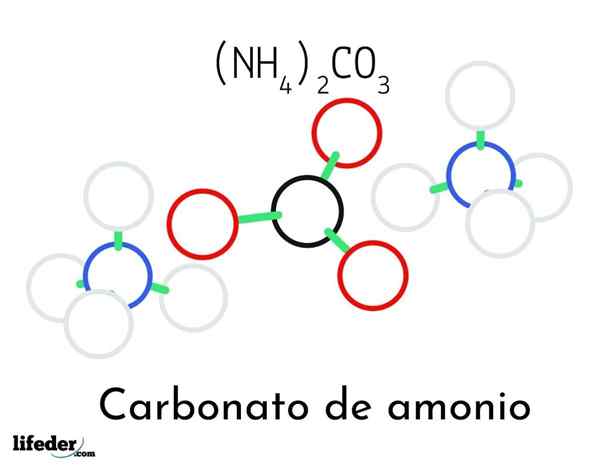
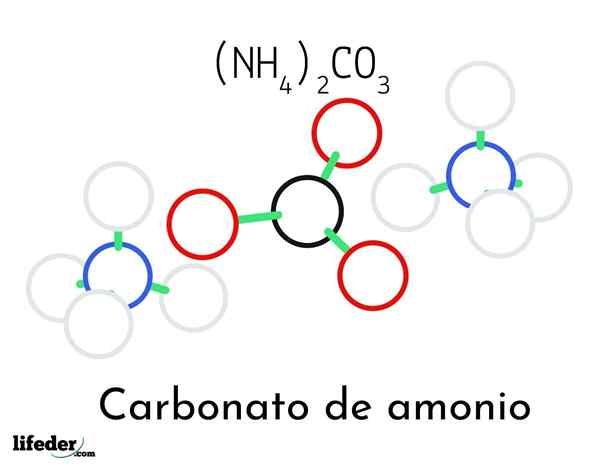
 Model amonijeve karbonatne strukture; Dva amonijasta in ena karbonatna kationa
Model amonijeve karbonatne strukture; Dva amonijasta in ena karbonatna kationa Na vrhunski sliki je prikazana kemična struktura amonijevega karbonata. Na sredini je Anion Co32-, Ravni trikotnik s črnim središčem in rdečo sfero; In na dve strani, amonijski kationi4+ s tetraedrskimi geometrijami.
Geometrija amonijevega iona je razložena s hibridizacijo SP3 dušikovega atoma in ureja vodikove atome (bele kroglice) okoli njega v obliki tetraedra. Med tremi ioni vzpostavijo vodikovi mostovi (h3N-h- o-co22-).
Zahvaljujoč svoji geometriji, en sam Co -Anion32- lahko tvori do tri vodikove mostove; medtem ko NH kationi4+ Morda ne morejo oblikovati ustreznih štirih vodikovih mostov zaradi elektrostatičnih odbojnosti med njihovimi pozitivnimi naboji.
Rezultat vseh teh interakcij je kristalizacija ortrorombičnega sistema. Zakaj je tako higroskopsko in topno v vodi? Odgovor je v istem prejšnjem odstavku: Vodikovi mostovi.
Te interakcije so odgovorne za hitro absorpcijo vode anhidridne soli (NH4)2Co3· H2Da). To ima za posledico spremembe v prostorski razporeditvi ionov in zato v kristalni strukturi.
Lahko vam služi: nikelj klorid (NICL2): struktura, lastnosti, pridobivanje, uporabeStrukturne radovednosti
Ne glede na to, kako preprosto je (NH izgleda4)2Co3, Tako občutljiv je na nešteto transformacij, da je njegova struktura skrivnost, predložena resnični sestavi trdne snovi. Ta struktura se razlikuje tudi glede na pritiske, ki vplivajo na kristale.
Nekateri avtorji so ugotovili, da so ioni naročeni kot koplanare, ki jih obloži vodikovi mostovi (to je veriga z zaporedjem NH4+-Co32--…) V katerih molekule vode verjetno služijo kot priključki z drugimi verigami.
Še več, preseganje kopenskega neba, kako so ti kristali v prostorskih ali medzvezdnih pogojih? Kakšne so vaše sestave v smislu stabilnosti gaziranih vrst? Obstajajo študije, ki potrjujejo veliko stabilnost teh kristalov, ujetih v ledene mase planetarja in kometov.
To jim omogoča, da služijo kot rezerve ogljika, dušika in vodika, ki se lahko s sončnim sevanjem pretvorijo v organske materiale, kot so aminokisline.
Se pravi, ti amonialni bloki sladoleda bi lahko bili nosilci "kolesa, ki začne stroje življenja" v kozmosu. Zaradi teh razlogov se zanimanje za področje astrobiologije in biokemije povečuje.
Uporaba/aplikacije
Uporablja se kot levci, saj segrevanje proizvaja ogljikov dioksid in amonijeve pline. Amonijev karbonat je, če želite, predhodnik sodobnega pecilnega praška in ga je mogoče uporabiti za peko piškotov in ravnih piškotov.
Vendar njegova uporaba za peko torte ni priporočljiva. Zaradi debeline tort se amonijevi plini zadržijo v notranjosti in ustvarijo neprijeten okus.
Lahko vam služi: cikloheksen: struktura, lastnosti, sinteza in uporabeUporablja se kot izkašljevanje, to je, da lajša kašlja, ko dekongestira bronhije. Ima fungicide, ki jih zaradi tega uporablja v kmetijstvu. Je tudi regulator kislosti, ki je prisotna v hrani in se uporablja pri sintezi organske sečnine pri visokih tlakih, in Hidantoinas.
Tveganja
Amonijev karbonat je zelo strupen. Pri ljudeh pri ljudeh povzroči akutno draženje ustne votline.
Poleg tega, če zaužitje povzroči draženje želodca. Podobno dejanje opazimo v očeh, ki so izpostavljeni amonijevi karbonatu.
Vdihavanje plinov razgradnje soli lahko draži nos, grlo in pljuča, kar povzroči kašelj in dihalne stiske.
Akutna izpostavljenost psom na amomanskem amonatu v odmerku 40 mg/kg teže, povzroči bruhanje in drisko. Najvišji odmerki amonijevega karbonata (200 mg/kg teže) so običajno smrtonosni. Srčna škoda je označena kot vzrok smrti.
Če se segreva pri zelo visokih temperaturah in v zraku, obogatenem s kisikom, oddaja strupene pline2.
Reference
- Pubchem. (2018). Amonijev karbonat. Pridobljeno 25. marca 2018 iz Pubchem: Pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Portal organske kemije. ((2009–2018)). Reakcija Bucherer-Bergs. Pridobljeno 25. marca 2018 s portala za organsko kemijo: www.Organsko-kemijo.org
- Wikipedija. (2018). Amonijev karbonat. Pridobljeno 25. marca 2018 iz Wikipedije: IN.Wikipedija.org
- Kemično podjetje. (2018). Kemično podjetje. Pridobljeno 25. marca 2018 od kemičnega podjetja: Thechemco.com