Spremembe vrst držav in njihove značilnosti (s primeri)
- 3752
- 1098
- Ms. Pablo Lebsack
The State spremembe ali faza je termodinamični pojav, kjer snov doživi reverzibilne fizične spremembe. Govori se, da je termodinamična, ker se med snovjo in okolico pojavi prenos toplote; Ali kaj je enako, obstajajo interakcije med snovjo in energijo, ki povzročajo preureditev delcev.
Delci, ki doživljajo spremembo statusa, ostajajo enaki pred in po istem. Tlak in temperatura sta pomembni spremenljivki v tem, kako sta v eni ali drugi fazi nameščena. Ko pride do spremembe stanja, se oblikuje dvofazni sistem, sestavljen iz iste zadeve v dveh različnih fizičnih stanjih.
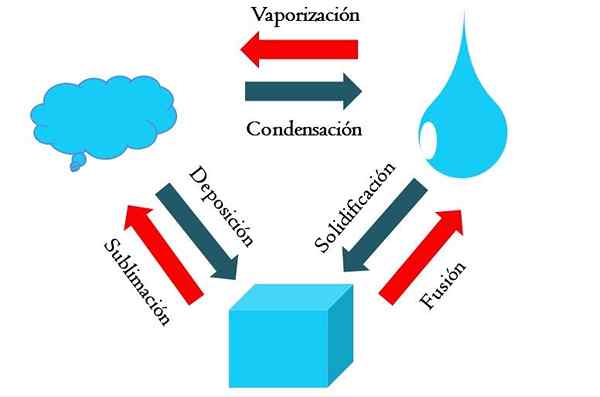
 State spremembe. Vir: Gabriel Bolívar
State spremembe. Vir: Gabriel Bolívar Višja slika prikazuje glavne spremembe stanja, ki jih je snov v normalnih pogojih.
Trdna kocka modrikaste snovi lahko postane tekoča ali plinasta, odvisno od temperature in tlaka okolice. Sama po sebi predstavlja eno fazo: trdno snov. Toda v času taljenja, torej taljenja, trdno-tekočina, imenovana Fusion (vzpostavljena je rdeča puščica med vedro in modro kapljico).
Da bi se zlila, mora kocka absorbirati toploto iz svoje okolice, da poveča temperaturo; Zato gre za endotermični proces. Ko je kocka staljena, je spet ena faza: tista tekočega stanja.
Ta blota lahko še naprej absorbira toploto, kar zvišuje njegovo temperaturo in povzroči nastanek plinastih mehurčkov. Spet obstajata dve fazi: ena tekočina in druga soda. Ko se vsa tekočina izhlapi skozi njegovo vrelišče, se nato reče, da se je kuhala ali uparila.
Zdaj so modrikaste kapljice spremenile v oblake. Do zdaj so bili vsi procesi endotermalni. Modrikast plin lahko še naprej absorbira toploto, dokler se ne segreje; Vendar se glede na kopenske pogoje to nasprotno ponavadi ohladi in kondenzira v tekočini (kondenzacija).
Po drugi strani je mogoče oblake odložiti tudi neposredno v trdni fazi, ki spet tvori trdno kocko (nalaganje). Ta zadnji dva procesa sta eksotermična (modre puščice); to pomeni, da sproščajo toploto v okolje ali okoli.
Poleg kondenzacije in odlaganja pride do spremembe stanja, ko blota zamrzne pri nizkih temperaturah (strjevanje).
[TOC]
Vrste sprememb stanja in njihove značilnosti
Slika prikazuje značilne spremembe za tri (najpogostejša) stanja snovi: trdna, tekočina in plinasta. Spremembe, ki jih spremljajo rdeče puščice, so endotermične, pomenijo absorpcijo toplote; Medtem ko so tiste, ki jih spremljajo modre puščice, eksotermične.
Spodaj bo narejen kratek opis vsake od teh sprememb, ki bo poudaril nekatere njegove značilnosti iz molekularnega in termodinamičnega sklepanja.
- Fuzija
Fuzija je sprememba stanja snovi iz trdne države v tekočino.

V trdnem stanju so delci (ioni, molekule, grozdi itd.) so "zaporniki", ki se nahajajo na fiksnih prostorih, ne da bi se lahko prosto gibali. Vendar se lahko vibrirajo na različnih frekvencah, in če so te zelo močne, se bo strog red, ki ga nalagajo medmolekularne sile.
Kot rezultat, dobimo dve fazi: ena, kjer se delci še naprej omejijo (trdni), in druga, kjer so svobodnejši (tekoči), dovolj, da povečajo razdalje, ki jih ločijo drug od drugega. Da bi to dosegli, mora trdna snov absorbirati toploto in tako bodo njeni delci vibrirali z večjo silo.
Lahko vam služi: atomska masa: definicija, vrste, kako jo izračunati, primeriZaradi tega je fuzija endotermična, in ko se začne.
Toplota, potrebna za to spremembo, se imenuje toplota ali taljenje entalpije (ΔHFus). To izraža količino toplote (v glavnem v enotah KJ), ki mora absorbirati mol trdne snovi, da se tali, in ne preprosto zviša njene temperature.
Snežna kepa
 Topi sneg z roko. Vir: Pixabay
Topi sneg z roko. Vir: Pixabay Glede na to se razume, zakaj se v roki topi snežna kepa (vrhunska slika). Sneg absorbira telesno toploto, ki je dovolj, da dvigne temperaturo snega nad 0 ° C.
Ledeni kristali, ki so prisotni v snegu. Medtem ko se sneg topi, oblikovana voda ne bo zvišala temperature, saj vsa toplota roke izkoristi sneg, da dokonča svojo fuzijo.
- Uparjanje

Izhlapevanje je sprememba stanja snovi iz tekočega stanja v plinasto.
Nadaljevanje s primerom vode, ki zdaj postavlja peščico snega v lonec in prižge ogenj, opazimo, da se sneg hitro stopi. Ko se voda segreva, se začnejo oblikovati majhni ogljikovi dioksidni mehurčki in druge možne nečistoče plina.
 Vrela voda. Vir: Pixabay
Vrela voda. Vir: Pixabay Toplota je molekularno razširila motene konfiguracije vode, ki širi volumen in poveča njen parni tlak; Zato obstaja več molekul, ki se izognejo površinskemu proizvodu za povečanje izhlapevanja.
Tekoča voda počasi zvišuje temperaturo zaradi visoke specifične toplote (4.184J/° C ∙ g) g). Obstaja točka, ko toplota, ki absorbira, ne uporablja več za dvig temperature, ampak za začetek ravnovesja med tekočino in hlapom; To pomeni, da začne vreti in vsa tekočina bo prešla v plinasto stanje, medtem ko absorbira toploto in ohranja temperaturno konstantno.
Tukaj opazimo intenziven mehurček na površini kuhane vode (vrhunska slika). Toplota, ki absorbira tekočo vodo, tako da je parni tlak njegovih začetnih mehurčkov enak zunanjemu tlaku, se imenuje entalpizacija uparjanja (ΔHVap).
Vloga pritiska
Pritisk je tudi odločen pri spremembah v stanju. Kakšen je njegov vpliv na uparjanje? Da je pri večjem tlaku večja toplota, ki mora absorbirati vodo, da zavre, zato se upari nad 100 ° C.
To je zato, ker povečanje tlaka otežuje pobeg iz molekul vode iz tekoče faze do sode.
Tlačni lonci uporabljajo to dejstvo v svojo korist za ogrevanje hrane v vodi pri temperaturi nad njihovo vrelišče.
Po drugi strani pa se vakuum ali zniža tlaka, tekoča voda potrebuje nižjo temperaturo, da se zavre in premakne na plinsko fazo. Z veliko ali malo pritiska mora voda v času vrela absorbirati svojo toploto uparjanja, da dokonča svojo spremembo stanja.
- Kondenzacija
Kondenzacija je sprememba stanja snovi iz plinastega stanja v tekoče stanje.
Vam lahko služi: galaktoza
Voda se je izhlavala. Kaj je naslednje? Vodna pala lahko še vedno zviša temperaturo in postane nevaren tok, ki lahko povzroči resne opekline.
Vendar pa predpostavimo, da se ohladi. Kot? Sproščanje toplote okolju in ob sprostitvi toplote se reče, da se dogaja eksotermični postopek.
Z sproščanjem toplote se začnejo upočasniti zelo energijske plinaste molekule. Tudi njene interakcije se začnejo učinkoviteje, ko se temperatura pare spušča. Prvič, kapljice za vodo, parni kondenzat, ki jim sledijo večje kapljice, ki jih bodo na koncu privlačile gravitacija.
Če želite popolnoma določiti določeno količino pare, morate sprostiti isto energijo, vendar z nasprotnim znakom pri ΔHVap; to pomeni, da je njegova kondenzacijska entalpija ΔHCond. Tako je obratno, parno-tekoče ravnovesje je stabilno.
Navlažena okna
 Kondenzacija vode. Vir: Pexels
Kondenzacija vode. Vir: Pexels Kondenzacijo lahko opazimo v samih okeh gospodinjstev. V hladnem vremenu se vodna paro, ki jo vsebuje v hiši, trči v okno, ki ima po njegovem materialu nižjo temperaturo kot druge površine.
Tam je molekule pare lažje, da se združijo in ustvarijo tanko belkasto plast, ki jo je enostavno odstraniti z roko. Ko te molekule sproščajo toploto (grelno steklo in zrak), začnejo tvoriti bolj številne grozde, dokler ne morejo kondenzirati prvih kapljic (zgornja slika).
Ko kapljice močno povečajo svojo velikost, drsijo skozi okno in pustijo sled vode.
- Strjevanje
Utrjevanje je sprememba stanja snovi iz tekočega stanja v trdno stanje.

Utrjevanje se pojavi zaradi hlajenja; Z drugimi besedami, voda zamrzne. Za zamrznitev mora voda sprostiti enako količino toplote, ki absorbira led, da se tali. Spet se ta toplota imenuje strjevanje ali zamrzovanje entalpije, ΔHKong (-ΔHFus).
Pri ohlajanju molekule vode izgubijo energijo in njihove medmolekularne interakcije postanejo močnejše in bolj usmerjene. Kot rezultat, jih naročijo zahvaljujoč svojim vodikovim mostom in tvorijo tako imenovane ledene kristale. Mehanizem, s katerim ledeni kristali vplivajo na njihov videz: prozoren ali bel.
 Skulptura ledu. Vir: Pixabay
Skulptura ledu. Vir: Pixabay Če ledeni kristali rastejo zelo počasi, ti ne oklupirajo nečistoče, na primer plini, ki se pri nizkih temperaturah v vodi solubilizirajo. Tako mehurčki pobegnejo in ne morejo komunicirati s svetlobo; In posledično je led tako prozoren kot izredni kip ledu (nadrejena slika).
Enako, ki se zgodi z ledom, se lahko zgodi s katero koli drugo snovjo, ki se utrdi s hlajenjem. Morda je to najbolj zapletena fizična sprememba prizemnih pogojev, saj je mogoče dobiti več polimorfov.
- Sublimacija
Sublimacija je sprememba stanja snovi iz trdne snovi v plin.

Lahko voda sublim? Ne, vsaj ne v normalnih pogojih (t = 25 ° C, p = 1 atm). Za sublimacijo mora biti sprememba trdnega stanja plina, parni tlak trdne snovi pa mora biti visok.
Prav tako je nujno, da njihove medmolekularne sile niso zelo močne, po možnosti, če so sestavljene le iz disperzijskih sil
Najbolj emblematičen primer je trden jod. Je kristalna trdna trdna siva-moralna tona, ki ima visok tlak s paro. Takšno je tako, da v svojem dejanju sledi vijolična para, katerih prostornina in širitev sta opazna, ko je pod segrevanjem.
Vam lahko služi: triethilamin: struktura, lastnosti, uporabe in tveganja Sublimacija joda. Vir: Belkina N V [CC do 4.0 (https: // creativeCommons.Org/licence/by/4.0)], iz Wikimedia Commons
Sublimacija joda. Vir: Belkina N V [CC do 4.0 (https: // creativeCommons.Org/licence/by/4.0)], iz Wikimedia Commons Na zgornji sliki je prikazan tipičen poskus, kjer trden jod izhlapi v stekleni posodi. Zanimivo in presenetljivo je opazovati, kako se vijolični hlapi širijo, in inicirani študent lahko preveri odsotnost tekočega joda.
To je glavna značilnost sublimacije: ni prisotnosti tekoče faze. Prav tako je endotermičen, saj trdna snov absorbira toploto, da poveča njen tlak na pari, da je enak zunanjemu tlaku.
- Odlaganje
 Jodo kristalna depozija. Vir: Stanislav.Nevyhosteny [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons
Jodo kristalna depozija. Vir: Stanislav.Nevyhosteny [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons Odlaganje je sprememba stanja snovi iz plinastega stanja v trdno stanje.
Vzporedno z eksperimentom sublimacije joda, imate to odlaganje. Odlaganje je nasprotna sprememba ali prehod: snov prehaja iz plinastega stanja v trdno snov brez nastanka tekoče faze.
Ko jodni vijolični hlapi pridejo v stik s hladno površino, sprostijo toploto, da jo ogrejejo, izgubijo energijo in ponovno prelivajo svoje molekule v sivino-muddijski trdni snovi (vrhunska slika). Je potem eksotermični postopek.
Odlaganje se pogosto uporablja za sintezo materialov, kjer se s prefinjenimi tehnikami dopinga s kovinskimi atomi. Če je površina zelo hladna, je izmenjava toplote med njo in parnimi delci nenadna, kar izpusti prehod skozi ustrezno tekočo fazo.
Toplota ali entalpija odlaganja (in ne Odlaganje) je sublimacija (ΔHSub=- ΔHD.E.P). Teoretično je mogoče sublimirati številne snovi, toda za dosego tega je treba manipulirati s pritiski in temperaturami, poleg tega, da ima pri roki njegov p proti t diagram; v katerem je mogoče vizualizirati njihove oddaljene možne faze.
Druge spremembe države
Čeprav niso omenjeni, obstajajo tudi druge države. Včasih je značilno, da imajo "malo vsakega", zato jih je kombinacija njih. Da bi jih ustvarili, je treba tlake in temperature manipulirati na zelo pozitivne (velike) ali negativne (majhne) veličine.
Tako bodo na primer, če se plini močno segrejejo, izgubili elektrone in njihova pozitivno obremenjena jedra v tem, da bo negativna plima pomenila tisto, kar je znano kot plazma. Je sinonim za "električni plin", saj predstavlja visoko električno prevodnost.
Po drugi strani, ko se temperature preveč spuščajo, se lahko snov obnaša nepričakovano; to pomeni, da imajo edinstvene lastnosti okoli absolutne ničle (0 k).
Ena od teh lastnosti je odvečnost in superprevodnost; kot tudi tvorba Bose-Einsteinovega kondenzata, kjer se vsi atomi obnašajo kot eno.
Tudi nekatere preiskave kažejo na fotonsko snov. V njih so delci elektromagnetnega sevanja, fotoni, združeni tako, da tvorijo fotonske molekule. To pomeni, da bi dali maso nekaterim lahkim telesom.
Reference
- Čelada, Anne Marie, ph.D. (19. november 2018). Seznam faznih sprememb med stanjem snovi. Okreval od: Thoughtco.com
- Wikipedija. (2019). Stanje materije. Pridobljeno iz: v.Wikipedija.org
- Dorling Kindersley. (2007). Spreminjanje stanja. Okrevano od: FactMonster.com
- Meyers ami. (2019). Sprememba faze: izhlapevanje, kondenzacija, freziranje, taljenje, sublimacija in odlaganje. Študij. Okrevano od: študij.com
- Bagley m. (11. april 2016). Zadeva: Opredelitev in pet stanja snovi. Okrevano od: Livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- « Drugi zakon formul termodinamike, enačbe, primeri
- Struktura kalijevega jodida (ki), lastnosti, pridobivanje, uporaba, tveganja »

