Struktura kalijevega jodida (ki), lastnosti, pridobivanje, uporaba, tveganja

- 4838
- 792
- Barry Ernser
On kalijev jodid Gre za anorgansko spojino, ki jo tvori kalijev ion (k+) in jodidni ion (i-). Njegova kemična formula je ki. Je bela kristalna trdna trdna snov, ionske narave in je zelo topna v vodi.
KI omogoča več kemijskih reakcij in analiz in se uporablja za merjenje količine ozona v atmosferi. Uporablja se tudi v opremi za infrardečo analizo (IR).
 Trden ki kalijev jodid. Ondřej mangl [javna domena]. Vir: Wikimedia Commons.
Trden ki kalijev jodid. Ondřej mangl [javna domena]. Vir: Wikimedia Commons. Kalijevi jodid se doda v skupno namizno sol, da se prepreči pomanjkanje joda pri ljudeh, saj lahko to predstavlja resen zdravstveni problem.
Uporablja se kot izkašljevanje, ker pomaga, da lahko sluz zlahka teče iz dihalnih kanalov zunaj. Služi tudi za zdravljenje nekaterih gliv in se uporablja v nekaterih kozmetiki.
Veterinarski zdravniki ga uporabljajo za zdravljenje živali pri težavah, podobnih ljudeh, kot so okužbe s kašljem in kožo. Dodaja se celo v zelo majhnih količinah živalim za živali.
[TOC]
Struktura
Kalijev jodid je ionska spojina, ki jo tvori kalijev kation k+ In Yoduro i anion-, Zato je med njimi povezava ionska. Status oksidacije kalija je +1, Valencia del jod.
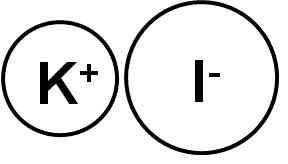 Kalijev jodid je ionska spojina. Avtor: Marilú Stea.
Kalijev jodid je ionska spojina. Avtor: Marilú Stea. Ki kalijevi jodidni kristali so kubični.
 Struktura ki kalijevega jodida. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Struktura ki kalijevega jodida. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Nomenklatura
- Kalijev jodid
- Kalijev jodid
Lastnosti
Fizično stanje
Kristalno bela trdna trdna snov. Kubični kristali.
Molekularna teža
166,003 g/mol
Tališče
681 ° C
Vrelišče
1323 ° C
Gostota
3.13 g/cm3
Topnost
Zelo topno v vodi: 149 g/100 g vode pri 25 ° C. Rahlo topen v etanolu in etru.
Vam lahko služi: Neon: Zgodovina, lastnosti, struktura, tveganja, uporabeph
Njegove vodne raztopine so nevtralne ali alkalne, s pH med 7 in 9.
Kemične lastnosti
Rahlo higroskopsko v vlažnem zraku.
Je stabilen v suhem zraku. Svetloba in vlaga pospešujeta njegovo razgradnjo in njene barve se spremenijo v rumeno zaradi sproščanja majhnih količin joda (i2) in yodatos (io3-).
KI Vodne rešitve postanejo tudi sčasoma rumene, vendar se lahko z malo alkalije izognete temu.
Te rešitve se raztopijo na jod (i2) Dati Ki3:
Yo- + Yo2 → i3-
Druge lastnosti
Ima močno grenki in slani okus. Ni vnetljivo.
Pridobivanje
Kalijev jodid lahko dobimo s segrevanjem joda (i2) V koncentrirani raztopini kalijevega hidroksida (KOH):
3 i2 + 6 Koh → 5 Ki + Kio3 + H2Tudi
Nastala raztopina Yodato in jodida se segreva za odpravo vode, zmanjša se na suhost, dodajamo in segrevamo pri visoki temperaturi. Premog jemlje kisik iz jodata in oksidira ogljikov dioksid, kar zmanjša jodid na jodid:
2 kio3 + C → 2 Ki + 3 Co2
Pridobljeni kalijev jodid lahko remificiramo, da ga očistimo. To pomeni, da se ponovno odkrije v vodi in se ponovno kristalizira.
Prijave
Pri zdravljenju hipertiroidizma
Kalijev jodid služi kot dodatno zdravljenje skupaj z drugimi antitiroidnimi sredstvi za zdravljenje hipertiroidizma.
Hipertiroidizem je bolezen, ki povzroči, da ščitnična žleza proizvaja preveč ščitničnega hormona, s povečano velikostjo ščitnice, zmanjšano težo osebe, pospešenega srčnega utripa in razdražljivosti, med drugimi simptomi.
 Ženska z vneto ščitnico. Lahko ga zdravimo s ki kalijevim jodidom. https: // www.Myupchar.com/in [cc by-sa (https: // createCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Ženska z vneto ščitnico. Lahko ga zdravimo s ki kalijevim jodidom. https: // www.Myupchar.com/in [cc by-sa (https: // createCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Pri bolnikih s hipertiroidizmom Ki hitro zmanjša simptome, ker zavira sproščanje ščitničnega hormona.
Njeni ščitnični učinki so: zmanjšali količino krvnih žil žleze, ponovno potrditev njihovih tkiv in zmanjšali velikost njihovih celic.
Zaradi tega velja za predoperativno zdravljenje, da sproži involucijo ali zmanjšanje velikosti ščitnice pred tiroidektomijo (odstranjevanje ščitnice), ker je ta operacija olajšana.
Vam lahko služi: natrij: zgodovina, struktura, lastnosti, tveganja in uporabeV drugih medicinskih aplikacijah
Kalijev jodid ima lastnosti, ko se izločanje dihalnih tekočin poveča, kar ima za posledico zmanjšano viskoznost sluznice.
 Kalijev jodid lahko deluje kot odkolečanje pri zdravljenju kašlja. Avtor: anastAball Gep. Vir: Pixabay.
Kalijev jodid lahko deluje kot odkolečanje pri zdravljenju kašlja. Avtor: anastAball Gep. Vir: Pixabay. Služi za zdravljenje eritem Nodoso, ki je boleče vnetje v nogah, v katerih nastanejo pordeli in povišana temperatura.
Je antihongos sredstvo. Omogoča zdravljenje sporotroze, ki je kožna okužba, ki jo povzroči gliva. Ta bolezen se zgodi z ljudmi, ki delajo z rastlinami in zemljo, kot so kmetje in vrtnarji.
Uporablja se tudi pri zdravljenju pomanjkanja joda ali da se mu izogne, zato dodajte namizno sol ali užitno sol (natrijev klorid naCl) kot vir joda in včasih v vodi, da pijete.
V veterinarskih aplikacijah
Kalijev jodid se živalim daje kot protiturivski, da se poveča in utemelji dihalni trakt tekočine, za bronhialni kronični kaše.
Služi tudi za mikozo (glivične okužbe) živali, za zmanjšanje srbenja in za kronično zastrupitev s svincem ali živo srebro.
Pri zaščiti ščitnice v radioaktivnih nujnih primerih
Kalijev jodid ima ščitnične zaščitne lastnosti, če je oseba izpostavljena jedrskemu sevanju.
KI preplavi ščitnico z nepadioaktivnim jodom in tako blokira odvzem radioaktivnih molekul in absorpcijo radioaktivnega joda, ki ščitnico ščiti pred rakom, ki lahko povzroči sevanje.
V ozonskih ukrepih v atmosferi
Ozonski plin (ali3) V atmosferi ga lahko merimo z uporabo elektrolitskih celic, imenovanih ozonosandas, ki jih prevažajo baloni radiosonde.
Vam lahko služi: benchilo benzoateTe elektrolitične celice vsebujejo raztopino kalijevega jodida ki kalijev. Celice so sprva v kemičnem in električnem ravnovesju.
Ko vzorec zraka z ozonom (ali3) Prodre v eno od celic, ki se zlomi, ker pride do naslednje reakcije:
2 ki + oz3 + H2O → i2 + Tudi2 + 2 Koh
Ta reakcija proizvaja električni tok, ki teče med celicami.
Količina proizvedenega električnega toka se nenehno prenaša z radijskimi valovi na postajo na kopnem. Na ta način dobimo ozonski profil, ki je od tal do višine kroglice.
 Balonski vzlet -Off z radiosondo s Ki za merjenje ozona. Hannes Grobe 19:27, 20. junij 2007 (UTC), Alfred Wegener Institute for Polar in Marine Research, Bremerhaven, Nemčija [CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/2.5)]. Vir: Wikimedia Commons.
Balonski vzlet -Off z radiosondo s Ki za merjenje ozona. Hannes Grobe 19:27, 20. junij 2007 (UTC), Alfred Wegener Institute for Polar in Marine Research, Bremerhaven, Nemčija [CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/2.5)]. Vir: Wikimedia Commons. V več uporabi
Kalijev jodid omogoča tudi:
- Odprava prostih radikalov, kot je hidroksilni radikal OH.
- Izdelava fotografskih emulzij, da se obori srebro.
- Izboljšajte krmo za živali, ko se dodate v mikrokontičnosti.
- Deodorizirajte gnojilo za govedo.
- Prenos infrardeče svetlobe spektra v opremi za analizo IR.
- Izvedite določene kemijske reakcije in analize v kemijskih laboratorijih.
- Uporabite ga v osebnih higienskih izdelkih.
- Izvajati analizo onesnaževanja okolja.
Tveganja
Nekateri ljudje občutljivi na jodid.
Tudi ljudje s tuberkulozo ali akutnim bronhitisom bi morali biti previdni.
KI lahko med drugimi simptomi povzroči mehčanje slinavk, lahko zažge usta ali grlo, nenavadno povečanje sline, bolečine v zob in vnetja dlesni in kovinskega okusa.
Prav tako lahko dražite oči in odprete rane na koži.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Kalijev jodid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Četrta izdaja. John Wiley & Sons.
- Dean, J.Do. (urednik). (1973). Langeov priročnik kemije. Elementh Edition. McGraw-Hill Book Company.
- Valković, v. (2019). Dekontaminacija po izpostavljenosti sevanju. Najbolj občutljivi deli telesa. V radioaktivnosti v okolju (druga izdaja). Okrevano od Scientirect.com.
- Smit, h.G.J. (2015). Kemija atmosfere-Oblocij za kemijo (in situ). V enciklopediji atmosferskih znanosti (druga izdaja). Okrevano od Scientirect.com.
- MuraliKrishna, i.V. in manickam, v. (2017). Analitične metode za spremljanje onesnaževanja na okolje. Pri upravljanju okolja. Okrevano od Scientirect.com.
- Wallace, J.M. in Hobbs, P.V. (2006). Atmosferska kemija 1. V atmosferski znanosti (druga izdaja). Okrevano od Scientirect.com.

