Drugi zakon formul termodinamike, enačbe, primeri

- 2529
- 332
- Percy Feeney
The Drugi zakon termodinamike ima več oblik izražanja. Eden od njih navaja, da noben termični stroj ni sposoben popolnoma pretvoriti vso energijo, ki jo absorbira v uporabno delo (Kelvin-Planck formulacija). Drug način za izjavo je reči, da se resnični procesi pojavljajo v takšnem smislu, da je kakovost energije nižja, ker je Entropija Ponavadi se povečuje.
Ta zakon, znan tudi kot drugo načelo termodinamike, je bil izražen na različne načine s časom, od začetka 19. stoletja do sedanjosti, čeprav njen izvor izvira iz ustanovitve prvih parnih strojev v Angliji, Na začetku 18. stoletja.
 Slika 1. Ko gradite gradbene bloke na tla, bi bilo zelo presenetljivo, če bi bil naročen padec. Vir: Pixabay.
Slika 1. Ko gradite gradbene bloke na tla, bi bilo zelo presenetljivo, če bi bil naročen padec. Vir: Pixabay. Toda čeprav je izražena na več načinov, v vsej ideji, da se zadeva ponavadi nereda in da noben proces 100%, saj izgube vedno obstajajo.
Vsi termodinamični sistemi se držijo tega načela, začenši s samim vesoljem do skodelice jutranje kave, ki tiho čaka na mizo in si z okoljem izmenja toploto.
Kava se ohladi, ko čas mineva, dokler ni v toplotnem ravnovesju z okoljem, tako da bi bilo zelo presenetljivo, če bi se nekega dne zgodi. Ni verjetno, da se bo zgodilo, nekateri bodo rekli, da je to nemogoče, vendar si je dovolj, da si predstavljamo, da ima predstavo o smislu, v katerem se stvari zgodijo spontano.
V drugem primeru, če bomo knjigo potisnili na površino mize, se bo sčasoma ustavila, ker se bo njegova kinetična energija izgubila v obliki toplote zaradi trenja.
Prvi in drugi zakon termodinamike sta bila ustanovljena okoli leta 1850, zahvaljujoč znanstvenikom, kot je Lord Kelvin -Creator iz izraza "termodinamika" -, William Rankine -avtor prvega formalnega besedila termodinamike -in Rudolph Clausius.
[TOC]
Formule in enačbe
Entropija -brez začetka -nas vzpostavi smisel, v katerem se stvari dogajajo. Vrnimo se na primer teles v termičnem stiku.
Ko se dva predmeta pri različnih temperaturah postavita v stik in končno po nekaj časa dosežeta toplotno ravnovesje, jih poganja dejstvo, da entropija doseže svoj maksimum, kadar je temperatura obeh enaka enaka.
Označevanje entropije kot S, Sprememba entropije ΔS sistema je podan:

Sprememba entropije ΔS Nakazuje stopnjo motnje v sistemu, vendar je pri uporabi te enačbe omejena: uporabna je le za reverzibilne procese, to je tiste, v katerih se lahko sistem vrne v prvotno stanje, ne da bi pustili znak tistega se je zgodilo-.
V nepovratnih procesih se drugi zakon termodinamike kaže na naslednji način:
Vam lahko služi: Reynolds Številka: za kaj je, kako se izračuna, vaje
Reverzibilni in nepovratni procesi
Pokal za kavo se vedno ohladi in je dober primer nepovratnega procesa, saj se vedno pojavi v eni smeri. Če se kavi doda smetana in mešamo, bo dobila zelo prijetno kombinacijo, vendar ne glede na to, kako spet mešamo, kava in smetana ne bosta več, ker je mešanje nepopravljivo.
 Slika 2. Razbijanje skodelice je nepopravljiv postopek. Vir: Pixabay.
Slika 2. Razbijanje skodelice je nepopravljiv postopek. Vir: Pixabay. Čeprav je večina dnevnih procesov nepopravljiva, so nekateri skoraj Reverzibilno. Reverzibilnost je idealizacija. Za izvedbo se mora sistem spremeniti zelo počasi, tako da je na vsaki točki vedno v ravnovesju. Na ta način ga je mogoče vrniti v prejšnjo stanje, ne da bi pustili oznako naokoli.
Procesi, ki so precej blizu tega ideala, so učinkovitejši, saj zagotavljajo večjo količino dela z manj porabe energije.
Sila trenja je odgovorna za velik del nepovratnosti, saj toplota, ki jo ustvarja, ni vrsta energije, ki jo iščejo. V knjigi, ki drsi po mizi, je toplota s trenjem energijo, ki se ne povrne.
Čeprav se knjiga vrne v prvotni položaj, bo miza vroča kot odtis prihoda in odhajanja.
Zdaj opazujte žarnico za žarilno žarnico: večino dela, ki ga opravi tok, ki prečka kontaktivo. Za oddajanje svetlobe se uporablja le majhen odstotek. V obeh procesih (knjiga in žarnica) se je entropija sistema povečala.
Prijave
Idealen motor je tisti, ki je zgrajen z reverzibilnimi procesi in nima trenja, ki povzroča energijske odpadke, ki se obračajo skoraj Vso toplotno energijo pri uporabnem delu.
Beseda skorajda poudarimo, ker niti idealen motor, ki je Carnotov, nima 100 -odstotne učinkovitosti. Drugi zakon termodinamike ni na ta način.
Carnot Engine
Carnotov motor je najučinkovitejši motor, ki ga je mogoče zasnovati. Deluje med dvema temperaturnima nahajališčih v dveh izotermalnih procesih - pri konstantni temperaturi - in dveh adiabatskih procesih - brez prenosa toplotne energije-.
Grafi, imenovani diagrami pv -pritiska - glasnost - pojasnijo situacijo:
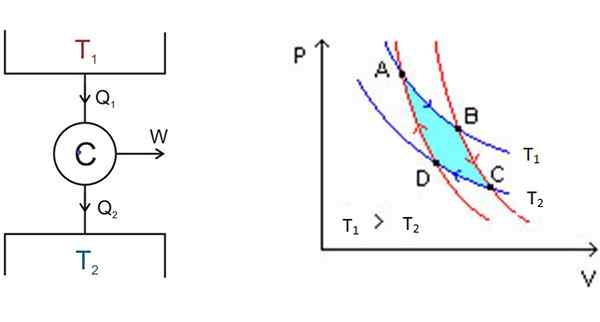 Slika 3. Na levi shemi motorja Carnot in na desni diagram P-V. Vir: Wikimedia Commons.
Slika 3. Na levi shemi motorja Carnot in na desni diagram P-V. Vir: Wikimedia Commons. Na levi strani je na sliki 3 motorna shema Carnot C, ki jemlje toploto Q1 depozita pri temperaturi t1, pretvorite to toploto v delo in to prepustite odpadki2 do najhladnejšega nahajališča, ki je pri temperaturi t2.
Začenši od A, se sistem širi, dokler ne doseže B, in absorbira toploto na fiksno temperaturo t1. V B se sistem začne adiabatsko širitev, v kateri toplota ne dobi ali izgubljena, da pride do C.
V C začne še en izotermalni postopek: dati toploto drugemu hladnejšemu toplotnemu nahajališču, ki je pri t2. Ker se to zgodi, je sistem stisnjen in dosežemo točko D. Začne se drugi adiabatski postopek za vrnitev na izhodišče. Na ta način je cikel zaključen.
Lahko vam služi: prenos toplote z vožnjo (s primeri)Carnotova učinkovitost je odvisna od temperatur v Kelvinu na dveh toplotnih nahajališčih:
Največja učinkovitost = (qvhod - Qizhod) /Qvhod = 1 - (t2/T1)
Carnotov teorem navaja, da je to najučinkovitejši toplotni stroj, vendar ga ne pohitite, da bi ga kupili. Se spomnite, kaj smo povedali o reverzibilnosti procesov? Zgoditi se morajo zelo, zelo počasi, zato je izhodna moč tega stroja praktično ničla.
Človeški metabolizem
Človeška bitja potrebujejo energijo, da vse svoje sisteme delujejo, zato se obnašajo kot toplotni stroji, ki prejemajo energijo in jo preoblikujejo v mehansko energijo, da se na primer premaknejo.
Učinkovitost in človeškega telesa pri opravljanju dela je mogoče opredeliti kot razmerje med mehansko močjo, ki jo lahko zagotovi, in skupnim vnosom energije, ki je priložena hrana.
Kot povprečna moč pm To je delo, opravljeno v časovnem intervalu ΔT, Lahko se izrazi kot:
Strm = W/ΔT
Ja ΔU/ΔT To je hitrost dodajanja energije, ostaja telesna učinkovitost:

S številnimi testi s prostovoljci je bila pridobljena učinkovitost do 17%, kar je več ur dostavilo približno 100 vatov moči.
Seveda bo to v veliki meri odvisno od opravljene naloge. Pedaliranje kolesa ima nekoliko večjo učinkovitost, približno 19 %, medtem ko ponavljajoče se naloge, ki vključujejo rezila, vrhove in motike.
Primeri
Drugi zakon termodinamike je impliciten v vseh procesih, ki se pojavljajo v vesolju. Entropija vedno raste, čeprav se v nekaterih sistemih zdi, da se zmanjšuje. Da bi se to drugje povečalo, tako da je v skupnem ravnovesju pozitivno.
- Pri učenju obstaja entropija. Obstajajo ljudje, ki se stvari dobro in hitro naučijo, poleg tega, da se jih lahko zlahka zapomnijo. Govori se, da gre za ljudi z nizko entropijo, vendar so zagotovo manj številni od tistih z visoko entropijo: tisti, ki se najbolj spominjajo stvari, ki jih preučujejo.
- Podjetje z neorganiziranimi delavci ima več entropije od tistega, v kateri delavci uresnično opravljajo naloge. Jasno je, da bo slednji učinkovitejši od prvega.
- Trenje sile ustvarjajo manj učinkovitosti pri delovanju strojev, saj povečajo količino razpršene energije, ki je ni mogoče učinkovito uporabiti.
- Začetek kocke ima večjo entropijo kot metanje kovanca v zrak. Konec koncev ima lansiranje valute samo 2 možna rezultata, medtem ko je lansiranje kock 6. Več več dogodkov je, več entropije obstaja.
Vam lahko služi: kakšni so elementi gibanja?Rešene vaje
Vaja 1
Valj z batom je napolnjen z mešanico tekočine in vodne pare pri 300 K in 750 kJ toplote se prenese v postopek stalnega tlaka. Kot rezultat, se tekočina znotraj valja izhlapi. Izračunajte spremembo entropije v postopku.
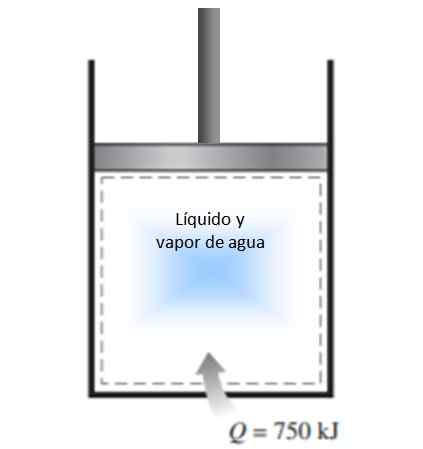 Slika 4. Slika za primer razrešen 1. Vir: f. Zapata.
Slika 4. Slika za primer razrešen 1. Vir: f. Zapata. Rešitev
Postopek, opisan v izjavi, se izvaja s konstantnim pritiskom v zaprtem sistemu, ki ne doživlja množične izmenjave.
Ker gre za uparjanje, med katerim se temperatura ne spreminja (med fazo je temperatura konstantna), je mogoče uporabiti definicijo zgoraj navedene sprememb entropije in temperatura lahko izpusti iz integrala:

ΔS = 750.000 J / 300 K = 2500 J / K.
Ker sistem pride v sistem, je sprememba entropije pozitivna.
Vaja 2
Plin trpi za povečanje tlaka za 2.00 do 6.00 Atmosfer (ATM), ki ohranja konstantno prostornino 1.00 m3, in nato razširite s konstantnim pritiskom, dokler ne doseže prostornine 3.00 m3. Končno se vrnite v prvotno stanje. Izračunajte, koliko dela se izvaja v 1 ciklu.
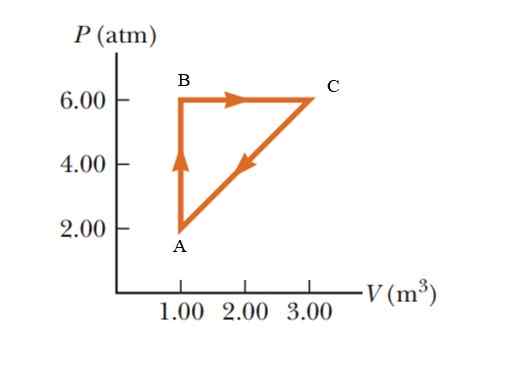 Slika 5. Termodinamični proces v plinu na primer 2. Vir: Serway -lulle. Osnove fizike.
Slika 5. Termodinamični proces v plinu na primer 2. Vir: Serway -lulle. Osnove fizike. Rešitev
Gre za ciklični postopek, v katerem je notranja sprememba energije nična, v skladu s prvim zakonom termodinamike, torej Q = W. V p -v diagramu (tlak - prostornina) je delo, opravljeno med cikličnim postopkom, enakovredno območju, zaklenjenem z krivuljo. Da bi dosegli rezultate v mednarodnem sistemu, je treba spremeniti enote v tlaku z naslednjim faktorjem pretvorbe:
1 atm = 101.325 kPa = 101.325 Pa.
Območje, zaprto s grafom, ustreza območju trikotnika, katerega baza (3 - 1 m3) = 2 m3 in katerih višina je (6 - 2 atm) = 4 atm = 405.300 Pa
WABCA = ½ (2 m3 x 405300 pa) = 405300 j = 405.3 kJ.
Vaja 3
Govori se, da je eden najučinkovitejših strojev, ki so bili zgrajeni.
Izračunajte: a) Največja teoretična učinkovitost, b) Mehanska moč, ki jo je stroj dostavil, če je absorbirana 1.40 x 105 J energije vsako sekundo iz vročega rezervoarja. Znano je, da je realna učinkovitost 42.0%.
Rešitev
a) Največja učinkovitost se izračuna z zgoraj navedeno enačbo:
Največja učinkovitost = (qvhod - Q izhod) /Qvhod = 1 - (t2/T1)
Če želite prenesti Celzija k Kelvinu, je dovolj, da dodate 273.15 pri Celzijski temperaturi:
Pomnoževanje za 100% imate največji odstotek učinkovitosti, kar je 67.2%
c) Če je realna učinkovitost 42%, obstaja največja učinkovitost 0.42.
Mehanska moč je: P = 0.42 x 1.40 x10 5 J/s = 58800 W.
Reference
- Bauer, w. 2011. Fizika za inženiring in znanosti. Zvezek 1. MC Graw Hill.
- Cengel in. 2012. Termodinamika. 7ma Izdaja. McGraw Hill.
- Figueroa, d. (2005). Serija: Fizika za znanost in inženiring. Zvezek 4. Tekočine in termodinamika. Uredil Douglas Figueroa (USB).
- Vitez, r. 2017. Fizika za znanstvenike in inženiring: strateški pristop.
- López, c. Prvi zakon termodinamike. Okrevano od: Culturacienta.com.
- Serway, r. 2011. Osnove fizike. 9na Cengage učenje.
- Univerza Sevilla. Termični stroji. Okreval od: laplace.nas.je
- « Načela, obdobja in vzorci odvetniške teorije
- Spremembe vrst držav in njihove značilnosti (s primeri) »


=0.672)